Rev.int.med.cienc.act.fís.deporte – vol. 8 -
número 29 - marzo 2008 - ISSN: 1577-0354
Ramos Álvarez,
J.J.; López-Silvarrey F.J.; Segovia Martínez, J.C.; Martínez Melen, H.; Legido
Arce, J.C. (2008). Rehabilitación del
paciente con lesión del ligamento cruzado anterior de la rodilla (LCA).
Revisión. Revista Internacional de Medicina y Ciencias de
REVISIÓN
REHABILITACIÓN DEL PACIENTE CON LESIÓN DEL LIGAMENTO CRUZADO ANTERIOR DE
PATIENT
REHABILITATION WITH ANTERIOR CRUCIATE LIGAMENT (ACL) INJURIE OF THE KNEE. REVIEW
Ramos Álvarez, J.J.*; López-Silvarrey F.J.*; Segovia
Martínez, J.C.*; Martínez Melen, H.**;Legido Arce, J.C.*
*Especialista en Medicina de
** Especialista en Medicina de
email correspondencia primer autor: jjramosa@med.ucm.es
Recibido:
24 de enero de 2008
Aceptado:
12 de febrero de 2008
CLASIFICACIÓN UNESCO:
Traumatología: 1315
Medicina Deportiva: 9915
RESUMEN
La rotura
del LCA representa el 50% de las lesiones ligamentosas de rodilla.
Produciéndose el 75% durante las actividades deportivas. La decisión sobre el
tratamiento quirúrgico o conservador depende de diferentes variables. El éxito en el tratamiento y la vuelta a la
actividad deportiva en las mejores condiciones posibles puede depender en gran
medida del proceso de rehabilitación.
En el
presente trabajo realizamos una revisión de los artículos más relevantes
publicados en los últimos años en relación a la rehabilitación posquirúrgica
del LCA. No encontramos resultados concluyentes que evidencien una diferente
recuperación en función del programa de ejercicios utilizado. No obstante, el
proceso de rehabilitación debe comenzar inmediatamente a la producción de la lesión.
La incorporación total al deporte se consigue en la mayoría de los casos en un
plazo medio de seis meses.
PALABRAS
CLAVE: Ligamento
cruzado anterior, rehabilitación, tratamiento quirúrgico,
ABSTRACT
ACL
breakage represents 50% of all knee ligament injuries and 75% of these occur
while practicing some form of sports. The decision regarding whether to apply
surgical or conservative treatment depends on different variables. The successful outcome of the treatment and
being able to return to normal sport activity in the best possible conditions
may largely depend on the rehabilitation process.
In this
article, we have carried out a review of the most relevant articles published
in the last few years regarding post-surgical ACL rehabilitation. We have not
found any conclusive results to demonstrate that recuperation differs depending
on the exercise program applied.
Nevertheless, the rehabilitation process should begin immediately
following the lesion having been produced. On average, in most cases, it is
possible to fully resume sports activities within an average of six months.
KEY WORDS: Anterior Cruciate Ligament, rehabilitation, surgery
treatment
INTRODUCCIÓN
La estabilidad funcional de la rodilla se debe en parte a
la normalidad y congruencia de las estructuras óseas, pero fundamentalmente
está determinada por la integridad funcional de los cuatro ligamentos mayores:
cruzado anterior, cruzado posterior, colateral medial y colateral lateral.
Así, las lesiones en cualquiera de estas
estructuras suelen provocar una alteración o variante de la estabilidad
biomecánica y funcional de la articulación.
La lesión más común es la que afecta al ligamento cruzado
anterior, representando el 50% de las lesiones ligamentosas de la rodilla,
produciéndose el 75% durante actividades deportivas (Gotlin
& Huie, 2000), y
afectando en mayor proporción a las mujeres que a los hombres.
El ligamento cruzado anterior (LCA), es una estructura
intra-articular, con una disposición póstero-anterior. Se origina en el cóndilo
femoral externo y se inserta a nivel antero-medial en la espina inter-tibial
medial. Su función principal es limitar la traslación anterior de la tibia
sobre el fémur, pero contribuye, además, a la estabilización en varo o valgo
excesivo y limita la hiperextensión (O´Connor,
Sallis, Wilder, & Patrick, 2004).
El mecanismo de lesión más frecuente, en el LCA, es la
rotación del fémur sobre una tibia fija
(pie apoyado) durante un movimiento de valgo excesivo o forzado (pivote).
También es común la hiperextensión de la rodilla, aislada o en combinación con
rotación interna de la tibia. Últimamente se han observado lesiones del LCA
durante una flexión forzada de rodilla, por lo que puede considerarse un tercer
mecanismo lesional.
El diagnóstico de esta lesión se realiza primeramente por anamnesis,
interrogando sobre el mecanismo lesional. Posteriormente, mediante la
exploración clínica valoramos la inestabilidad articular. Finalmente,
utilizando los métodos de diagnostico por imagen, principalmente
Durante el interrogatorio clínico, el 40% de los pacientes
refieren haber sentido un chasquido o “pop” en el momento de la lesión, seguido
de una sensación de luxación y, en la mayor parte de los casos, con una
incapacidad para continuar la actividad deportiva (O´Connor
et al., 2004; Torry et al., 2004).
En las horas siguientes, alrededor del 70% de los afectados
desarrollará un hemartros severo, por lo que durante la exploración física, es
frecuente encontrar una pérdida de los contornos normales de la articulación y
una inflamación importante. Si realizamos una artrocentesis lo habitual es un
líquido con abundante sangre.
La maniobra
exploratoria de Lachman, descrita en cualquier manual de exploración de la
rodilla, tiene una sensibilidad del 87
al 98%, considerándose la prueba clínica de elección para el diagnóstico. Con
menor sensibilidad diagnóstica disponemos de las maniobras del cajón anterior
y del pivote.
La sensibilidad y especificidad diagnóstica de
La decisión sobre el tratamiento, quirúrgico o conservador,
dependerá de diferentes variables. Son fundamentales el grado de inestabilidad
y limitación funcional de la rodilla, contrastados con los objetivos futuros en
actividad física. También son importantes, la presencia de lesiones asociadas,
la edad, y las circunstancias sociales, familiares y económicas del paciente.
Fu y Schulte (Fu &
Schulte, 1996) recomendaron las siguientes
indicaciones de tratamiento quirúrgico: 1) atleta activo que desea continuar en
alto nivel competitivo, 2) pacientes que presentan lesión de menisco reparable
acompañada de lesión de LCA, 3) lesión completa con otro ligamento lesionado y
4) pacientes que experimente gran inestabilidad en actividades de la vida cotidiana.
El éxito del tratamiento quirúrgico dependerá también de
muchas variables, entre las que destacamos, las propiamente quirúrgicas
(técnica quirúrgica, tipo de injerto seleccionado, tensión o fijación aplicada
al injerto), y las que se derivan del proceso de rehabilitación. Estas últimas
son de igual o mayor importancia que las primeras. (Menetrey,
Duthon, Laumonier, & Fritschy, 2008)
SELECCIÓN DEL PROGRAMA REHABILITACIÓN
Paralelamente a la decisión sobre el
tratamiento, conservador o quirúrgico de la lesión, debe seleccionarse el
programa de rehabilitación. Este debe planificarse de forma individualizada en
función de los siguientes factores: tipo de tratamiento (conservador o
quirúrgico), técnica quirúrgica utilizada, objetivos después del tratamiento y
posibilidades o recursos de rehabilitación.
En cualquier caso las estrategias y el
objetivo común de la rehabilitación pre y/o post quirúrgicas es buscar el mejor
nivel funcional para el paciente evitando el riesgo de una nueva lesión. Ambos
se consiguen eliminando la inestabilidad, restaurando la movilidad, recuperando
la fuerza y alcanzando e incluso mejorando las capacidades físicas previas a la
lesión.
Al igual que han progresado los
procedimientos quirúrgicos (técnica, injertos, etc.) La rehabilitación también está evolucionando continuamente. La
consecuencia directa es una más rápida y mejor recuperación del deportista.
Inicialmente los protocolos eran
absolutamente limitantes. En el siglo pasado, los protocolos descritos
limitaban la movilidad, impedían el apoyo y obligaba al uso prolongado de
muletas. En 1990, Shelbourne y Niz revolucionan la rehabilitación, con un
protocolo que pretende incorporar a los atletas a actividades deportivas en 8
semanas, aplicando un programa que se caracteriza por la rápida recuperación
del rango de movimiento articular (ROM) y el apoyo casi inmediato (Shelbourne & Nitz, 1990).
1 / FASES DEL PROGRAMA DE
REHABILITACIÓN DEL LCA
El proceso de rehabilitación de la
lesión de LCA puede ser conceptualmente organizado en distintas fases. Una
etapa inicial o inmediata a la lesión y
una fase de consolidación. En ocasiones
la distinción entre las fases puede resultar algo arbitraria. Quizás lo realmente importante es poner el
énfasis en las prioridades del tratamiento y los objetivos de la
rehabilitación, aunque, tratando de mantener un orden sistemático y lógico.
Sería de gran utilidad, plasmar en un
documento escrito las prioridades del tratamiento, los objetivos de la
rehabilitación, las fases y el orden sistemático establecido, lo que facilitará
su cumplimiento y la comunicación entre el médico, el fisioterapeuta y el
paciente.
1.1 / Fase Inmediata (Posterior a la
lesión y prequirúrgica)
Los
objetivos de esta fase persiguen minimizar
la inflamación, evitar el dolor, conservar o aumentar el arco de
movilidad, mantener la fuerza muscular e iniciar la relación del paciente con
el equipo de tratamiento y rehabilitación (médico, enfermero, fisioterapeuta).
Para
controlar el dolor y la inflamación se utilizan habitualmente medios físicos
(crioterapia) y frecuentemente antinflamatorios no esteroides (AINES).
Superada
la inflamación y el dolor, se inicia la movilización de la extremidad para
disminuir o prevenir la pérdida del arco de movilidad.
Teniendo
en cuenta que, a causa de la inflamación y la inmovilización, el cuadriceps, puede perder hasta el 30% de su fuerza
muscular en los primeros 7 días (De Andrade, Grant, & Dixon,
1965), es fundamental que en esta fase
se minimice la perdida de fuerza y masa muscular. Con ello conseguiremos que el
paciente acceda en las mejores las condiciones físicas y funcionales a las
primeras fases del programa de rehabilitación en el tratamiento no
quirúrgico/conservador o a las fases de consolidación tras el tratamiento
quirúrgico.
Para conseguir este
objetivo muscular, es importante conocer las alteraciones biomecánicas
producidas por la lesión del LCA previamente a la aplicación de las cargas.
El paciente con lesión del LCA presenta diversas modificaciones
biomecánicas (Torry et al., 2004; Williams, Barrance,
Snyder-Mackler, & Buchanan, 2004):
a) Una alteración de la marcha en
semiflexión, que le exige una mayor funcionalidad de la musculatura
isquiotibial (aumento de la fuerza y prolongación de la acción muscular).
b) Alteración del torque
flexo-extensor en fase de apoyo.
c) Deterioro muscular del
cuadriceps, que le obliga a una serie de estrategias musculares dinámicas y
estáticas para la estabilización de la articulación.
d) Limitación de la
extensión y rotación de su rodilla, con la sobrecarga y posiblemente daño al
cartílago y meniscos articulares.
Del mismo modo, la
lesión del LCA determina modificaciones nerviosas, como son la disminución de
la propiocepción y la kinestesia y la alteración del reclutamiento muscular
(cuadriceps e isquiotibiales).
Existen diferentes
métodos para el mantenimiento y la recuperación del tono muscular:
El uso de los
ejercicios isométricos es de gran utilidad en esta primera etapa. (Fig. 1).
Aunque su utilización y beneficio, no han sido suficientemente contrastados,
existen algunos datos que le asignan una aceptable relación beneficio/riesgo (L.C. Thomson, Handol, &
Cunningham, 2005).
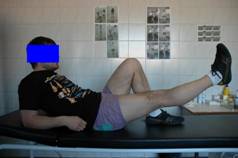
Fig. 1.
Ejercicios isométricos de cuadriceps.
El riesgo de daño
articular y meniscal es mínimo, especialmente si lo comparamos con los ejercicios
dinámicos/isotónicos, mientras que los beneficios expresados con parámetros de
fuerza e hipertrofia muscular son similares a los que aporta el trabajo
dinámico/isotónico, hechos ya descritos hace décadas por Zohn y Leach (Leach, Stryker, & Zohn, 1965;
Zohn, Leach, & Stryker, 1964).
En esta primera fase de rehabilitación
inmediata, ya sea con pacientes quirúrgicos o en pacientes con tratamiento
conservador, es fundamental que el sujeto adopte unos estilos de vida en los
que disminuyan o desaparezcan las actividades de alto impacto o que impliquen
el mecanismo de pivote (giros, cambios de dirección, aceleración,
deceleración,…).
1.2 / Fase Post Quirúrgica
La
fase post quirúrgica, a su vez se subdivide en diferentes etapas.
1.2.1 / Fase Post Quirúrgica I
También llamada de
recuperación temprana, alcanza las primeras 2-4 semanas tras la intervención.
Tiene como objetivos
fundamentales, completar la extensión y recuperar el control muscular (Beynnon et al., 2002; Cascio,
Culp, & Cosgarea, 2004; Kvist, 2004). La recuperación del arco de
movilidad se extiende hasta las dos semanas después de la intervención (Gotlin & Huie, 2000; Kvist,
2004).
Esta fase post
quirúrgica es importante el manejo del dolor y el control de la inflamación (Beynnon et al., 2002; Cascio et
al., 2004; Kvist, 2004). El control adecuado de estos
factores contribuye a la consecución de los objetivos posteriores de la
rehabilitación. Es fundamental para la consecución de estos objetivos y la
reincorporación a actividades más estresantes, conseguir actuar sobre el
injerto para mejorar su función.
Las cargas axiales
provocan alineamiento de las células y favorecen la cicatrización (Beynnon et al., 2002; Cascio et
al., 2004). Normalmente transcurridos 6
meses (3 meses con injerto de Isquiotibiales) el injerto ya tiene las
características adecuadas, similares a un LCA y similares a las que muestra en
12 meses (Majima, Yasuda, Tago, Tanabe,
& Minami, 2002). Por eso el consenso general
sobre la capacidad de incorporación de los diferentes tipos de injertos no
difiere significativamente y suele estar entre los 3-6 meses.
El control de la
inflamación y el dolor promueve el
control neuromuscular y la activación del cuadriceps, lo cual ayuda a mantener la extensión y
facilita la deambulación (Majima et al., 2002).
En esta etapa, para
alcanzar el control del dolor e inflamación es frecuente el uso de analgésicos
orales, AINES e incluso narcóticos. Con ellos se hace tolerable el dolor durante
la realización de los ejercicios de extensión y control de cuadriceps.
La utilización de la
crioterapia, ya sea en simples bolsas con hielo o actualmente en sistemas de
flujo frío continuo, proporciona un excelente mecanismo de control de la inflamación
y el dolor.
La recuperación del
arco de movilidad es, sin duda, el aspecto más importante de esta fase. La
movilización temprana de la articulación después de la reconstrucción del LCA
puede reducir el dolor, disminuye los cambios adversos al cartílago articular,
favorece la nutrición articular, promueve la cicatrización y previene la
contracción de la cápsula articular (Barber-Westin & Noyes, 1993;
Mackenzie et al., 1996; Siegel & Barber-Westin, 1998).
Ya que la pérdida
del arco de movilidad, en extensión y en flexión es un hecho frecuente tras la
cirugía, se plantea como fundamental, obtener una extensión completa y una
flexión a 90° en la primera semana post quirúrgica.
El arco de movilidad
se incrementa utilizando una combinación de ejercicios activos y pasivos de
forma progresiva.
Aunque algunos
estudios demuestran que los sistemas de movilidad pasiva continua tienen un
mayor beneficio, el costo/ beneficio de los mismos, no justifica su utilización (Beynnon et al., 2002; Kvist,
2004).
Un aparato de
movilidad pasiva continua se aplica típicamente de 4-6 horas/día durante 2-3
semanas. Cuando el sujeto alcanza los 90° se aplica de forma discontinua (Barber-Westin & Noyes, 1993;
Gotlin & Huie, 2000; Siegel & Barber-Westin, 1998).
Aquellos pacientes
con retraso en los objetivos, que no alcancen la extensión completa en dos
semanas, deben tratarse más agresivamente. Para ello son útiles ciertas
maniobras como: colgar la extremidad en posición prona, hacer presión manual o
aplicar estiramiento forzado. (fig. 2)
Maniobras similares
pueden ser utilizadas en el déficit de la flexión, en sentido inverso, pero
siempre cuidando el limite de los 90°. (fig. 3). En caso de continuar con dolor
o inflamación, los métodos antes mencionados pueden seguir administrándose.
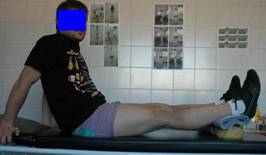
Fig. 2.
Estiramiento forzado.

Fig. 3. Flexión
activa asistida.
El apoyo progresivo
facilita la recuperación del cuadriceps y consecuentemente disminuye el dolor
en la región anterior de la articulación. El apoyo temprano hace que el
paciente mejore su fuerza, mejore el grado de confianza y normalice su patrón
de marcha lo antes posible (Barber-Westin & Noyes, 1993).
Diferentes
protocolos difieren en el tiempo necesario para permitir el apoyo, por la
idoneidad o no del uso de rodilleras, etc.
Hay autores que
propugnan la sustentación de un tercio del peso auxiliado por muletas en los
primeros días y progresan al apoyo total hacia los 4-7 días (L.C. Thomson et al., 2005).
Actualmente se
debate la utilización del apoyo temprano. El apoyo ocasiona una traslación
anterior de la tibia, pero sus efectos no están bien estudiados. Tyler (Tyler, McHugh, Gleim, &
Nicholas, 1998) comparando dos grupos: uno con
apoyo inmediato y otro con apoyo dos semanas después, no encontró diferencias
entre ellos en la laxitud a los 7 meses de seguimiento, aunque el 40% tenía más
de 3mm de desplazamiento anterior de la tibia.
Hay escuelas que
consideran de utilidad el uso de rodillera, para proporcionar seguridad a los
pacientes durante la marcha. Suele aconsejarse cuando hay dolor/inflamación con
actividades normales, si la medición del desplazamiento anterior de la tibia
supera los
Algunos protocolos
utilizan inmovilizadores durante 24 horas, retirando su aplicación durante la
terapia física y progresando en su retirada de acuerdo a los avances de la
función muscular, y sustituyéndolos por rodilleras funcionales que limitan los
grados de movilidad según las pautas y necesidades del programa de
rehabilitación (L.C. Thomson et al., 2005).
Algunos autores no
encontraron diferencias en la estabilidad de la rodilla a los dos años de la
reconstrucción de LCA, tras el seguimiento de dos grupos, uno con recuperación
de ROM temprano y otro con inmovilización (Miklebust & Bahr, 2005).
Durante esta fase
post quirúrgica I, el trabajo de la propiocepción se inicia en la primera semana (1ª fase de rehabilitación de
la propiocepción), utilizando el simple levantamiento de un peso y aprovechando
el inicio del apoyo (Hewett, Paterno, & Myer,
2002; Hogervorst & Brand, 1998).
1.2.2 / Fase Post Quirúrgica II
En esta fase
intermedia, que transcurre entre la 6ª y 10ª semanas, todavía existe cierta
debilidad en el injerto, pues aunque los extremos del mismo se han incorporado
a los túneles, el resto del tejido injertado probablemente mantenga cierta
vulnerabilidad (Cascio et al., 2004; Gotlin &
Huie, 2000).
Los objetivos
planteados son: completar el arco de movilidad alcanzando la flexión y la
hiperextensión, fortalecer la musculatura del miembro afectado, mejorar la
propiocepción y recuperar el patrón de marcha.
Para alcanzar dichos
objetivos, existe una serie de ejercicios que simultáneamente proporcionan el
conjunto de los beneficios deseados.
Comenzando por orden inverso, tenemos
debemos recordar, que la recuperación del patrón normal de la marcha, se
relaciona directamente con la movilidad y especialmente con el fortalecimiento
del cuadriceps. Caminar frente a un espejo realizando todas las fases de la
marcha es un método fundamental para la recuperación progresiva de la misma
(Fig. 4).

Fig. 4. Marcha frente a espejo.
El fortalecimiento muscular, aspecto
fundamental de esta fase, se justifica por diferentes hechos fisiológicos y
biomecánicos, que avalan su beneficio en este momento de la rehabilitación.
La debilidad muscular es un hecho
común en las lesiones agudas y crónicas. En los pacientes de más larga evolución
se acompaña de hipotrofia, la cual por tamaño y sección transversal disminuida,
condiciona una menor fuerza muscular. Por ello en toda lesión del LCA, pero
especialmente en los crónicos de larga evolución, se precisa un trabajo
específico de fortalecimiento muscular, que será proporcional al deterioro
funcional alcanzado (Kai-Nan, 2002).
La función muscular, no sólo depende
del tamaño y la sección, sino que está condicionada por aspectos biomecánicos
estáticos y dinámicos que afectan a músculos y articulaciones. Para iniciar el
trabajo de fortalecimiento muscular, es necesaria una estabilidad articular que
resulta del equilibrio estático y dinámico de las estructuras, la propiocepción
y la coordinación. La influencia de estos factores sobre la estabilidad de la
articulación ha hecho que los programas de ejercicios trabajen simultáneamente
sobre dichos componentes.
Por otro lado para el trabajo de
fortalecimiento con seguridad se requiere que las fuerzas aplicadas mantengan
una buena relación beneficio/riesgo sobre la articulación afectada.
En este sentido, con carácter general,
se ha demostrado que las cargas que inciden
sobre el tejido conectivo son beneficiosas para la plasticidad y remodelación biológica de los tejidos en
cicatrización. Igualmente, con carácter específico para los injertos de LCA, se
demostrado que las cargas mecánicas que actúan sobre el tejido del injerto
pueden facilitar la cicatrización del mismo, aunque si la carga es excesiva
puede producir la rotura parcial o total del injerto (Ellen, Young, & Sarni, 1999).
En la misma línea de evaluar y
garantizar la seguridad del injerto, Beynnon demostró que tras la
reconstrucción del LCA, aparece una necrosis y revascularización de las fibras,
que no aparecen orientadas hasta los 3-6 meses, pudiendo existir un riesgo de
fallo en el injerto hasta los 8 meses después de la reconstrucción (Beynnon et al., 2002). Otros autores tan sólo
encontraron necrosis en el 30% de los injertos a las 3-8 semanas, utilizando un
autoinjerto de tendón patelar (B. Rougraff, Shelbourne, Gerth,
& Warner, 1993; B. T. Rougraff & Shelbourne, 1999). En su conjunto, los resultados
demuestran que la tensión constante a la que se ve sometido el injerto se
produce en situaciones biomecánicas distintas a las normales, independientemente
de la calidad del mismo (Ellen et al., 1999; Kvist, 2004;
Paternostro-Sluga, Fialka, Alacamliogliu, Saradeth, & Fialka-Moser, 1999).
Todos estos hechos
constituyen el fundamento biológico del inicio de fortalecimiento en esta fase,
orientado a recuperar el tono muscular para posteriormente iniciar la
musculación. Swat demostró que un programa de fortalecimiento en esta etapa es
seguro y beneficia la rehabilitación a corto y mediano plazo (Shawt, 2005).
A continuación
exponemos algunos criterios para la elección de los ejercicios de
rehabilitación que se consideran más seguros.
Teniendo en cuenta
que los movimientos de traslación en el plano sagital pueden perjudicar el
proceso de remodelación del injerto, cualquier ejercicio de rehabilitación del
LCA debe evitar la traslación en este plano.
En la mediada que ganamos ROM y a la
hora de elegir entre ejercicio dinámicos, se ha visto que las técnicas de
fortalecimiento que utilicen la contracción concéntrica y excéntrica de forma
combinada o simultánea, son más
efectivas que los utilizan una sola (Frontera, 2003; Kraemer, 2003;
L.C. Thomson et al., 2005).
En pacientes con serios problemas de
movilidad se han planteado la posibilidad de utilizar electroestimulación, sin
embargo los beneficios no son significativos (Paternostro-Sluga et al., 1999;
L.C. Thomson et al., 2005).
Los isquiotibiales y el cuadriceps son
los grupos musculares prioritarios en el fortalecimiento muscular que se
realiza en esta fase. Las razones son múltiples:
a) La estabilidad de la rodilla,
objetivo en esta fase, depende principalmente de ambos músculos (cuadriceps e
isquiotibiales).
b) Los isquiotibiales se consideran
los principales agonistas del LCA, pues su contracción disminuye la tensión en
el injerto o en el LCA, dando una protección activa contra el desplazamiento
anterior de la tibia. Por ello el fortalecimiento de los isquiotibiales es una
parte importante del fortalecimiento, que contribuye al patrón de marcha y las
actividades deportivas.
En este sentido el cuadriceps no se
considera un músculo positivo, pues su contracción en rangos de flexión de 0-75
grados, provoca traslación anterior de la tibia sobre el fémur.
Igualmente, se ha mostrado
recientemente que los gastrocnemios actúan como antagonista del LCA, pues su
contracción provoca traslación posterior del fémur, flexiona la rodilla y
comprime la articulación. La contracción de ambos músculos genera incremento de
la tensión del LCA o del injerto (Bowen et al., 2004; Ellen et al.,
1999; Escamilla et al., 1998).
En el entrenamiento funcional de la
fuerza, se debate actualmente la mayor utilidad o beneficio de los ejercicios
de cadena cinética cerrada (CCC) y de cadena cinética abierta (CCA).
Los ejercicios de CCA son aquellos en
que la última articulación de la extremidad (cadena) se encuentra con el arco
de movilidad libre. Como ejemplo: la máquina de extensión de pierna “leg extensión”
y de flexión de pierna “leg curl” (figuras 5 y 6).
Este tipo de ejercicios genera fuerzas
encontradas (cortantes) sobre la articulación y causan una sobrecarga
transversal, perpendicular al eje axial de la articulación (Gotlin & Huie, 2000).
Los ejercicios de CCC son aquellos que
se realizan con la articulación final y su arco de movilidad fijos a una
superficie. Como ejemplos: la prensa de piernas (leg press), la bicicleta, etc.
(figura. 7).
En este caso las fuerzas generadas
sobre la articulación son de tipo axial, causando en todo caso sobrecarga
vertical (Gotlin & Huie, 2000).


Figura 5. Ejercicio
de cadena cinética abierta. “leg extensión”.


Figura 6. Ejercicio de cadena
cinética abierta. “leg curl”


Fig. 7. Ejercicio de cadena
cinética cerrada. “leg press”
Los ejercicios CCC
teóricamente son los más indicados y seguros para esta etapa pues la
co-contracción muscular durante su ejecución aumenta la estabilidad de la
articulación y protege al injerto de las fuerzas transversales/cortantes de
desplazamiento anterior.
Los programas con
ejercicio de CCC, reproducen mejor la biomecánica normal, estimulando por este
camino la propiocepción, la funcionalidad, y minimizando el estrés fémoro-patelar
y las fuerzas encontradas, cortantes y transversales sobre la articulación (Cascio et al., 2004; Escamilla et
al., 1998; Gotlin & Huie, 2000; Kvist, 2004).
Recientemente y
mediante estudios clínicos comparativos las diferencias encontradas en la generación de fenómenos de
desplazamiento tibial en programas de
rehabilitación con ejercicios exclusivamente de CCC versus programas mixtos con
CCC y CCA, no han existido o no han sido significativas.(Miklebust & Bahr, 2005;
Shawt, 2005). En base a estos hallazgos los
ejercicios de CCA pueden ser iniciados en esta fase, aunque están más indicados
posteriormente, en la fase siguiente.
Durante esta fase, es importante continuar
insistiendo en la recuperación de la propiocepción. La propiocepción se define
como una actividad compleja que incluye una interacción entre las vías
sensoriales (sistema aferente que recibe información) y las motoras (sistema
eferente que ejecuta movimiento). Ha llegado a conocerse como el sistema
sensorio-motor (Hewett et al., 2002).
Varios autores consideran que el LCA,
además de estabilizador, tiene una función propioceptiva (sensorial). Diversos
autores encontraron receptores sensoriales propioceptivos en las fibras del
LCA, estableciendo una falta de correlación entre la insuficiencia del
ligamento y la estabilidad funcional (Heroux & Tremblay, 2005;
Hewett et al., 2002; Hogervorst & Brand, 1998; Pitman, Nainzadeh, Menche,
Gasalberti, & Song, 1992).
Por todo esto, parece ineludible
combinar el trabajo de fortalecimiento con la propiocepción. El entrenamiento
neuromuscular (fortalecimiento muscular y propiocepción) es un mecanismo que
mejora el sistema nervioso (recepción de información) para generar una
contracción muscular rápida y óptima (respuesta efectora), contribuyendo a la
mejora de la coordinación y al reaprendizaje de los patrones de movimiento. Los
ejercicios de CCC favorecen este objetivo (O´Connor et al., 2004) (figuras 8 y 9). Diversos autores
han constatado beneficios en la función articular desarrollado un programa de
rehabilitación neuromuscular basado en el conocimiento de la cicatrización del
injerto de LCA, en los mecano receptores y en el control muscular (Hogervorst & Brand, 1998;
Risberg, Beynnon, Peura, & Uh, 1999; Zatterstrom, Friden, Lindstrand, &
Moritz, 2000).
Al inicio los ejercicios deben ser
estáticos, enfatizando la co-contracción de la musculatura alrededor de la
articulación.
Cuando el paciente ya puede mantenerse
en pie y apoyar todo el peso, se inician ejercicios como “caminar de puntera” o
“los pasos de lado”.
Posteriormente estos ejercicios pueden
hacerse dentro del agua e incorporando varias texturas en la base de soporte (Cascio et al., 2004; Hewett et
al., 2002; Hogervorst & Brand, 1998; Kvist, 2004).
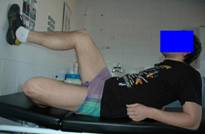

Fig. 8 y 9. Trabajo combinado de fortalecimiento y propiocepción
mediante ejercicios de cadena cinética cerrada.
El balance sobre una tabla de
equilibrio y entrenamiento de estabilidad se realizan al final de esta fase
(figura 10). Conseguimos una mayor estimulación
disminuyendo los estímulos aferentes visuales (mantener lo ojos
cerrados), de esta manera obligamos al sistema vestibular y propioceptivo a
mantener el balance articular (Hewett et al., 2002).
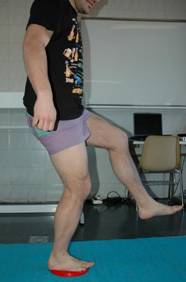
Fig. 10. Ejercicios de balance y estabilidad para mejorar la
propiocepción.
Finalmente, algunos
autores han apuntado la utilidad de la inyección intraarticular de ácido
hialurónico durante esta fase de la rehabilitación. Huang y col han encontrado
mejoras en la velocidad de deambulación y en la fuerza muscular en pacientes
que han recibido inyecciones intraarticulares de ácido hialurónico a partir de la
8ª semana en comparación con el grupo control(Huang, Yang, & Chou, 2007).
1.2.3 / Fase Post Quirúrgica III
Denominada fase de recuperación o fase
progresiva funcional, incluye una variedad de ejercicios con el objetivo
principal de recuperar y/o mejorar las cualidades físico-deportivas básicas
(flexibilidad, fuerza máxima, fuerza resistencia, resistencia aeróbica) que
permitan al paciente lesionado iniciar la carrera y abordar los ejercicios
funcionales específicos de cada actividad o deporte (Cascio et al., 2004; Frontera,
2003; Kvist, 2004). Para los deportistas supone la
fase de transición a sus actividades deportivas normales.
Esta fase se inicia aproximadamente a los 2 o
3 meses después de la reconstrucción. Ya que, hasta las 13 semanas, el injerto
no se ha incorporado completamente. A partir de ese momento el injerto responde
a las fuerzas de tensión para remodelarse y someterse al proceso de
incorporación funcional como sustituto del LCA. Se han descrito varios factores
que contribuyen al fracaso del injerto tras la reconstrucción del LCA,
independientemente de los factores biológicos propiamente dichos, un factor importante
sería el control del programa rehabilitador (Menetrey et al., 2008).
Los ejercicios de flexibilidad forman
parte de la metodología en esta fase. La elección del tipo de ejercicio depende
de las circunstancias.
Con carácter general, por su fácil
aprendizaje se recomiendan técnicas estáticas tipo contracción-relajación. Recomendamos
la asistencia de un profesional fisioterapeuta, para ayudar a la realización de
técnicas más complejas en cuanto al aprendizaje y su ejecución, pero a su vez
más efectivas, como la técnica de contracción-relajación-contracción-antagonista.
Se recomienda, en la mayoría de los
casos, de 4-7 repeticiones estáticas de contracción-relajación, con una
duración de 30-40 segundos cada fase en dos sesiones por día.
Aunque existe controversia y
discrepancias sobre la eficacia de los diferentes métodos, el protocolo
propuesto parece el más razonable teniendo en cuenta la duración de los efectos
del estiramiento, la facilitación propioceptiva que proporciona y la mínima
presencia del reflejo miotático, no deseable en este tipo de trabajo (Frontera, 2003; Kraemer, 2003).
El trabajo de fortalecimiento muscular,
es de gran importancia en esta fase, pues se ha demostrado que, con el tiempo,
cualquier injerto, por debilidad estructural, puede aumentar el grado de
traslación anterior de la rodilla lesionada (Beynnon et al., 2002).
Los métodos y las técnicas a utilizar,
se han debatido frecuentemente en los últimos años. La presión y el deseo de
reincorporar, lo antes posible, a los deportistas/atletas de alto rendimiento a
su deporte, han contribuido a la aparición de un gran número de protocolos de
fortalecimiento acelerado. Estos programas acelerados pueden adaptarse y ser de
utilidad para los pacientes no deportistas.
Como ya hemos mencionado, la técnica
de fortalecimiento mixta que utilice la contracción concéntrica y excéntrica de
forma simultánea se considera más efectiva.
En esta etapa, los ejercicios de CCC
pueden no ser suficientes para el fortalecimiento del cuadriceps, por lo que se
recomiendan, por su mayor efectividad ejercicios de CCA y CCC (Fleming, Oksendahl, &
Beynnon, 2005; L.C. Thomson et al., 2005). Con este entrenamiento combinado,
los pacientes y/o deportistas regresan a su nivel previo a la lesión, con 2
meses de antelación a los que entrenan tan sólo con CCC. Por otro lado los
ejercicios en CCA conducen a un aumento significativo de la fuerza del
cuadriceps en relación a los ejercicios en CCC (Tagesson, Oberg, Good, &
Kvist, 2008). Por tanto, recomendamos la
incorporación de los ejercicios de CCA y mantenerlos a partir de esta etapa.
Aunque las recomendaciones son
variables, los ejercicios en máquinas de musculación (“leg extensión”, poleas,
etc.), se prescriben con una frecuencia semanal mínima de 2-3
sesiones, con un volumen por sesión de 3-5 series con 8-12 repeticiones cada
serie. El tiempo de recuperación varía de 2-4 minutos entre cada serie. La
carga o intensidad del esfuerzo se sitúa entre el 60-80% de 1RM (máxima carga para una sola
repetición) (Frontera, 2003; Kraemer, 2003). Las cargas deben ser progresivas
(ejercicios de resistencia progresiva), manteniendo una intensidad relativa.
Finalmente, es importante destacar que
los programas de fortalecimiento en domicilio, se han mostrado tan eficaces
como los realizados en un centro de rehabilitación (Fischer, Tewes, Boyd, Smith,
& Quick, 1998).
La recuperación de la resistencia
aeróbica, también constituye un objetivo en esta etapa. El tipo de actividades
aconsejadas para este entrenamiento, son las que afecten a grandes masas
musculares y puedan realizarse a intensidad moderada. La natación, la carrera
continua y el ciclismo estarían indicados en la última etapa de esta fase.
En esta etapa, incorporamos tres
nuevas fases en la rehabilitación de la propiocepción:
La primera o Fase III de la
propiocepción, se basa fundamentalmente en aumentar la dificultad de los
ejercicios. Los pasos de lado se realizan de puntas y/o con rotación de los
pies 90°, se introducen actividades con un solo pie y aplicando resistencia en
el pie no involucrado. Para aumentar la dificultad, se agregan actividades
simultáneas de disbalance en extremidades inferiores y coordinativas de extremidades
superiores (figuras 11, 12).

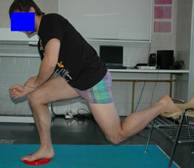
Figuras. 11 y 12. Ejercicios complejos de
La segunda fase o Fase IV de
rehabilitación de la propiocepción, vamos aumentando la dificultad de los
ejercicios en apoyo monopodal (saltar en un trampolín o sobre superficies de
diferentes texturas con una sola pierna).
La tercera fase o Fase V de la
rehabilitación de la propiocepción, se introduce la carrera en línea recta. Posteriomente,
progresamos con carrera hacia atrás o con esfuerzos submáximos laterales (Hewett et al., 2002).
1.3 / Fase de Entrenamiento funcional
Considerada la fase más próxima al
retorno a las actividades físicas y deportivas, se inicia transcurridas 16
semanas de la cirugía.
Se considera una fase de preparación
específica para el retorno a las actividades funcionales completas del ejercicio
y deporte (Cascio et al., 2004; Gotlin &
Huie, 2000).
Uno de los primeros objetivos en esta
etapa es conseguir la permanencia o estabilidad sobre un solo pié.
La carrera, otro elemento importante
en esta fase, debe ir progresando paulatinamente en distancia, tiempo y
frecuencia semanal, dejando el incremento de la intensidad/velocidad para una etapa posterior.
En esta y en las etapas anteriores, el
paciente debe ser instruido para
reconocer e informar ante la aparición de dolor o inflamación, hechos objetivos, que reflejan sobrecarga. De
producirse esta complicación, el paciente además de aplicar las medidas
analgésicas y antinflamatorias habituales (crioterapia, vendaje compresivo,
etc.), debe revisar el programa de trabajo y reducir la sobrecarga (intensidad,
duración, frecuencia…).
En esta última etapa se inician los
ejercicios pliométricos, que utilizan fase inicial de contracción
concéntrica, seguida por otra fase de
contracción excéntrica (Cascio et al., 2004; Mackenzie et
al., 1996; L.C. Thomson et al., 2005). Para iniciar este tipo de
ejercicios, se pueden subir y bajar escalones pequeños mediante saltos con
ambas extremidades (Hewett et al., 2002).
Finalmente, es necesario introducir y
aplicar un programa de actividades en el que practiquen cambios de ritmo
(aceleración, deceleración) y dirección (cortes). Como ejemplo podemos citar
las “cariocas” (pasos de lado con cambios de dirección y velocidad) o la
“carrera hacia atrás”.
1.4 / Retorno al Ejercicio Físico o al
Deporte
La mayoría de los estudios (Cascio et al., 2004; Gotlin &
Huie, 2000; Kvist, 2004) sobre rehabilitación de LCA
consiguen un retorno completo a las actividades deportivas en un plazo medio de
6 meses.
Para actividades concretas existen
datos con amplios rangos y valores medios (Frontera, 2003). El tiempo medio de regreso a la
carrera es de 4,3 meses, con un rango entre 3-12 meses. La recuperación del
sujeto para el salto, se produce en un tiempo medio de 6 meses, con un rango
entre 3-12 meses.
Para los deportes de bajo impacto, la
media de recuperación es de 5 meses, con rangos entre 3-9 meses. La
incorporación a los deportes de impacto medio se produce a los 5,8 meses, con
rangos entre 4-9 meses. Por último para participar en deportes de alto impacto
el tiempo medio estimado es de 8,1 meses, con variabilidad entre 4-18 meses (Frontera, 2003).
Como conclusión podemos afirmar que la
mayoría de los estudios sobre rehabilitación de las lesiones de LCA, permiten
la carrera tras 2-3 meses de la cirugía, y practicar actividades deportivas a
los 6 meses después de la intervención quirúrgica, por término medio.
Hay autores que no encontraron
diferencias significativas cuando el regreso a las actividades deportivas se
anticipó ligeramente (menos de 6 meses) (Glasgow, Gabriel, Sapega,
Glasgow, & Torg, 1993).
Tampoco disponemos de estudios
suficientes para establecer si una u otra técnica quirúrgica puede anticipar o
retrasar el retorno a las actividades deportivas. Ni siquiera la presencia de
lesiones concomitantes como la meniscopatía, parecen influir en los tiempos de
recuperación (Gotlin & Huie, 2000).
1.4.1 / Pruebas Funcionales y Recomendaciones
para el Retorno
Por encima de la celeridad del retorno
a la práctica deportiva, debemos colocar siempre la seguridad del paciente,
especialmente en las actividades deportivas extenuantes o de alto impacto.
Para garantizar la seguridad en el
retorno, es fundamental recordar unas condiciones o criterios mínimos: (Bowen et al., 2004; Cascio et
al., 2004; Gotlin & Huie, 2000; Kvist, 2004).
a)
Objetivos de la cirugía: estabilidad funcional estática y dinámica de la
rodilla, control de las lesiones asociadas si las hubiera.
b)
Objetivos de rehabilitación: ausencia de dolor e inflamación, arco de movilidad
completo, suficiencia en la fuerza y desempeño muscular, equilibrio funcional.
c) Otros objetivos: psicológicos y
sociales.
La valoración de cada paciente debe
hacerse mediante pruebas funcionales, teniendo en cuenta, que no siempre hay una correlación entre el
resultado de las pruebas y su aplicación posterior en el deporte.
Las pruebas de capacidad muscular y
estabilidad funcional más utilizadas son: el salto a distancia con una sola
pierna, el triple salto a distancia con una sola pierna y la prueba de salto
vertical.
Las pruebas de salto a distancia con un solo pié son parte del “International
Knee Documentation Commite Store”
(IKDCS), que se utilizan para medir la funcionalidad. Con este método es
habitual que, a los 6 meses, la extremidad rehabilitada muestre un déficit del
8-18% con respecto a la extremidad sana. Esto demuestra que todavía existe un
déficit de la función muscular en el
momento habitual de retorno a la práctica deportiva (Gotlin & Huie, 2000).
Aunque no se ha debatido lo suficiente
sobre el déficit muscular permitido para retornar a la práctica deportiva,
deberíamos considerar inadmisible un déficit mayor del 15% de la fuerza
muscular isocinética, antes de regresar a las actividades deportivas. Tampoco
parece razonable retornar a la actividad deportiva con un déficit superior al
10% en la prueba de salto a distancia con una pierna según el IKDCS.
Dicho en otros términos, el
umbral/criterio necesario de fuerza
isocinética que permite el retorno a las actividades deportivas es,
alcanzar el 85-90% de fuerza de isquiotibiales y el 85-95% del cuadriceps, en
la extremidad rehabilitada con respecto al lado sano (Cascio et al., 2004).
A la hora de aplicar estos criterios,
hay que tener en cuenta, que en los hombres, la
fuerza de isquiotibiales y cuadriceps, deben alcanzar un valor que supere un
40% y un 80% de su peso corporal respectivamente.
En el caso de las mujeres el porcentaje estaría en un 35% y un 70%.
Todos estos datos deben de ser contrastados
con una situación clínica compatible, es decir, ausencia de sintomatología y la
estabilidad de la rodilla (Cascio et al., 2004; Kvist, 2004).
La prueba de estabilidad estática
puede realizarse valorando el desplazamiento anterior de la rodilla mediante un
artrómetro (Ejemplos: KT1000 o KT2000). Shelbourne y Niz, evaluaron el grado de
desplazamiento anterior de la rodilla en un grupo de pacientes lesionados,
antes y tras el regreso al deporte, encontrando que el 30% tenía más de 3mm. de
desplazamiento (Shelbourne & Nitz, 1990) .
Aunque algunos autores consideran
seguros los desplazamientos inferiores a 3mm., actualmente se establece que
valores inferiores a 5mm., pueden considerarse igualmente seguros para permitir
al lesionado el retorno al ejercicio físico y al deporte.
Marcacci, tras realizar un seguimiento de la estabilidad de
la rodilla a un grupo de atletas, encontró
que el 40% presentaba a los 4 meses el mismo nivel de desplazamiento que el
previo a la lesión, el 40% a los 4-6 meses y el 20% entre 6-8 meses. Según este
mismo autor, el 45% de los pacientes tuvieron más de 3mm de desplazamiento a
los 3 años de seguimiento. A los cinco años, el 92% de los pacientes
consideraba su rodilla “normal” (Marcacci et al., 2003), evidentemente, este dato no es
objetivo, ya que la sensación de normalidad no se correlaciona con la laxitud
ligamentosa (Kvist, 2004). Por tanto, la laxitud ligamentosa,
debe ser contrastada con las manifestaciones subjetivas del paciente y su grado
de funcionalidad en el test de Lysholm y Tegner (Cascio et al., 2004; Hasan, 2004;
Kvist, 2004).
Un individuo que complete con éxito,
todas las pruebas funcionales, obtenga resultados negativos, e incluso presente
alguna prueba aislada en el límite inferior de la normalidad, puede iniciar
gradualmente su práctica deportiva.
Miklebust y Bahr, tras una revisión
bibliográfica, constataron que entre el 41-92% de los pacientes sometidos a
reconstrucción de LCA alcanzaron su nivel de actividad previa a la lesión.
Aunque se obtuvieron resultados similares cuando el tratamiento había sido
conservador, alcanzando el 82%. (Miklebust & Bahr, 2005).
En cualquier caso existe gran
variabilidad en los resultados debido a la falta de homogeneidad de las muestras,
a los diferentes niveles de competitividad, al deporte practicado, al programa
rehabilitación, etc… (Miklebust & Bahr, 2005; L.C.
Thomson et al., 2005).
COMPLICACIONES TRAS
Uno de los principales problemas en
relación con el retorno a las actividades deportivas y el ejercicio físico tras
la lesión del LCA, es la incidencia de recaídas o re lesión del ligamento y/o
estructuras adyacentes (menisco, cartílago u otros ligamentos).
Pocos estudios han evaluado la
frecuencia de la ruptura de injerto, pero los datos disponibles hablan del
2,3-13%. Dentro de este amplio rango de variabilidad, el mayor índice de lesión
fue encontrado por Miklebust en el balonmano (Miklebust & Bahr, 2005). Drogset y Grondvedt encontraron
también altos índices de recaída en deportes de alto impacto, alcanzando una
frecuencia de recaída del 12% en un seguimiento de 8 años (Drogset & Grontvedt, 2002).
Miklebus en su reciente revisión
encontró diferencias en las complicaciones de los pacientes con lesión de LCA,
dependiendo del tratamiento utilizado (conservador o quirúrgico). Observó que
el 22% de los pacientes con tratamiento conservador necesitaron cirugía por
lesión de menisco, mientras que fue necesaria en tan sólo el 12% de los pacientes
sometidos a reconstrucción (Miklebust & Bahr, 2005).
Por lo tanto, es probable que el
regresar a deportes de alto impacto o de pivote sin tratamiento quirúrgico
supone un aumento del riesgo de lesión meniscal.
Independientemente del tratamiento
utilizado, la lesión del LCA suele aumentar la posibilidad de una osteoartrosis
(OA) en el futuro, cuyo principal factor etiológico se encontrará en las cargas
subsecuentes en los próximos años.(Gillquist
& Messner, 1999; Lane, 1995; Neyret, Donell, DeJour, & DeJour, 1993;
Neyret, Donell, & Dejour, 1993). El riesgo de desarrollar una OA tras una lesión de LCA es,
aproximadamente del 50% a los 10 años. Una extrapolación de estos datos indica
que casi de todos los pacientes desarrollarán una OA entre los 15-20 años
posteriores a la lesión (Miklebust & Bahr, 2005).
Finalmente, es importante destacar que
asumir que la reparación de un LCA, de un menisco o del cartílago convierte a
la rodilla lesionada en “normal”, puede ser un equívoco. Según Lohmander, tras
la reparación de LCA se requieren muchos años para alcanzar la normalidad
biomecánica. Hay que tener en cuenta, que la práctica deportiva, especialmente
de impacto o pivote contribuye a desgastar la articulación de la rodilla y que
una articulación lesionada presenta una estabilidad/movilidad,
significativamente diferentes a pesar del tratamiento o de la rehabilitación.(Lohmander & Roos, 1994)
CONCLUSIÓN
Los programas de rehabilitación de la
rotura del LCA con o sin cirugía, han evolucionado notablemente. Sin embargo
tras una revisión sistemática encontramos que la mayoría de los artículos
consultados no detalla suficientemente la metodología utilizada, tan sólo
describen los beneficios de las cargas sobre el injerto y su cicatrización. Los
diferentes autores estudian la técnica quirúrgica que permita una
rehabilitación acelerada, pero no profundizan en los detalles del proceso
rehabilitador. Sin duda esto limita el resultado de nuestro trabajo e incluso
de las revisiones sistemáticas consultadas. Recientes
revisiones no encuentran resultados concluyentes que evidencien una diferente
recuperación en función del programa de ejercicios utilizado (L. C. Thomson, Handoll,
Cunningham, & Shaw, 2007; Trees, Howe, Dixon, & White, 2005; Trees,
Howe, Grant, & Gray, 2007).
En cualquier caso consideramos de gran utilidad, muchos de
los datos expuestos en esta revisión,
que contribuirán a una visión más referenciada de los pacientes
lesionados que desean recuperar su actividad diaria y volver a la práctica de
ejercicio y deporte.
Como resumen y teniendo en cuenta las dificultades
mencionadas, esquematizamos en la tabla 1 las diferentes fases en la
rehabilitación postquirúrgica del LCA y los criterios para abordar las mismas.
TABLA 1: Programa
propuesto de Rehabilitación tras cirugía del LCA
FASE INMEDIATA
Primera semana tras la cirugía
-Control del dolor y la
inflamación
-Ejercicios isométricos
-Apoyo sin muletas hacia el
4º día
FASE POSTQUIRÚRGICA I
-Control del dolor y la
inflamación
-Ejercicios activos y
pasivos para mejorar el arco de movilidad
-Extensión completa
y flexión a 90º
-1ª fase de recuperación de
la propiocepción
FASE POSTQUIRÚRGICA II
-Ejercicios activos y
pasivos para mejorar el arco de movilidad
-Hiperextensión y
flexión completa
-Potenciación muscular
-Ejercicios
concéntricos y excéntricos en CCC
-Ejercicios de marcha
-2ª fase de recuperación de
la propiocepción
FASE POSTQUIRÚRGICA
III
-Potenciación muscular
-Ejercicios
concéntricos y excéntricos en CCC y en CCA
-Ejercicios de carrera
-Recuperación resistencia
aeróbica
-Natación,
bicicleta
-3ª fase de recuperación de
la propiocepción
FASE ENTRENAMIENTO
FUNCIONAL
4 meses tras la cirugía
-Aumento progresivo de la
carrera en distancia e intensidad
-Ejercicios pliométricos
FASE RETORNO A
BIBLIOGRAFÍA
Barber-Westin,
S. D., & Noyes, F. R. (1993). The effect of rehabilitation and return to
activity on anterior-posterior knee displacements after anterior cruciate
ligament reconstruction. Am J Sports Med,
21(2), 264-270.
Beynnon, B. D., Johnson, R. J., Fleming, B. C.,
Kannus, P., Kaplan, M., Samani, J., et al. (2002). Anterior cruciate ligament
replacement: comparison of bone-patellar tendon-bone grafts with two-strand
hamstring grafts. A prospective, randomized study. J Bone Joint Surg Am, 84-A(9), 1503-1513.
Bowen, T. R., Feldmann, D. D., & Miller, M. D.
(2004). Return to play following surgical treatment of meniscal and chondral
injuries to the knee. Clin Sports Med, 23(3),
381-393, viii-ix.
Brandsson, S., Faxen, E., Kartus, J., Eriksson, B.
I., & Karlsson, J. (2001). Is a knee brace advantageous after anterior
cruciate ligament surgery? A prospective, randomised study with a two-year
follow-up. Scand J Med Sci Sports, 11(2),
110-114.
Cascio,
B. M., Culp, L., & Cosgarea, A. J. (2004). Return to
play after anterior cruciate ligament reconstruction. Clin Sports Med, 23(3), 395-408, ix.
De Andrade, J. R., Grant, C., & Dixon, A. (1965).
Joint distension and reflex inhibition inthe knee. J Bone Joint Surg Am., 47, 313-322.
Drogset, J. O., & Grontvedt, T. (2002). Anterior
cruciate ligament reconstruction with and without a ligament augmentation
device : results at 8-Year follow-up. Am
J Sports Med, 30(6), 851-856.
Ellen, M. I., Young, J. L., & Sarni, J. L.
(1999). Musculoskeletal rehabilitation and sports medicine. 3. Knee and lower
extremity injuries. Arch Phys Med
Rehabil, 80(5 Suppl 1), S59-67.
Escamilla, R. F., Fleisig, G. S., Zheng, N.,
Barrentine, S. W., Wilk, K. E., & Andrews, J. R. (1998). Biomechanics of
the knee during closed kinetic chain and open kinetic chain exercises. Med Sci Sports Exerc, 30(4), 556-569.
Fischer, D. A., Tewes, D. P., Boyd, J. L., Smith, J.
P., & Quick, D. C. (1998). Home based rehabilitation for anterior cruciate
ligament reconstruction. Clin Orthop
Relat Res(347), 194-199.
Fleming, B. C., Oksendahl, H., & Beynnon, B. D.
(2005). Open- or closed-kinetic chain exercises after anterior cruciate
ligament reconstruction? Exerc Sport Sci
Rev, 33(3), 134-140.
Fleming, B. C., Renstrom, P. A., Beynnon, B. D.,
Engstrom, B., & Peura, G. (2000). The influence of functional knee bracing
on the anterior cruciate ligament strain biomechanics in weightbearing and
nonweightbearing knees. Am J Sports Med,
28(6), 815-824.
Frontera, W. R. (2003). Exercise and musculoeskeletal
rehabilitation (Restoring optimal form and function). The Physician and Sports Med, 31(12), 39-45.
Fu, F. H., & Schulte, K. R. (1996). Anterior
cruciate ligament surgery 1996. State of the art? Clin Orthop Relat Res(325), 19-24.
Gillquist, J., & Messner, K. (1999). Anterior
cruciate ligament reconstruction and the long-term incidence of gonarthrosis. Sports Med, 27(3), 143-156.
Glasgow, S. G., Gabriel, J. P., Sapega, A. A.,
Glasgow, M. T., & Torg, J. S. (1993). The effect of early versus late
return to vigorous activities on the outcome of anterior cruciate ligament
reconstruction. Am J Sports Med, 21(2),
243-248.
Gotlin, R. S., & Huie, G. (2000). Anterior
cruciate ligament injuries. Operative and rehabilitative options. Phys Med Rehabil Clin N Am, 11(4),
895-928.
Hasan, H. A. (2004). Tegner and Lysholm scores in
brace-free rehabilitation. Saudi Med J,
25(12), 1962-1966.
Heroux, M. E., & Tremblay, F. (2005). Weight
discrimination after anterior cruciate ligament injury: a pilot study. Arch Phys Med Rehabil, 86(7), 1362-1368.
Hewett, T. E., Paterno, M. V., & Myer, G. D.
(2002). Strategies for enhancing proprioception and neuromuscular control of
the knee. Clin Orthop Relat Res(402),
76-94.
Hogervorst, T., & Brand, R. A. (1998).
Mechanoreceptors in joint function. J
Bone Joint Surg Am, 80(9), 1365-1378.
Huang, M. H., Yang, R. C., & Chou, P. H. (2007).
Preliminary effects of hyaluronic acid on early rehabilitation of patients with
isolated anterior cruciate ligament reconstruction. Clin J Sport Med, 17(4), 242-250.
Kai-Nan. (2002). Muscle force and its role in joint
dynamic stability. Clin Orthop Relat Res,
403S, S37-S42.
Kraemer, W. J. (2003). Strenght training basics:
designing workouts to meet patients´goals. Phys
Sportsmed, 31(8), 39-45.
Kvist, J. (2004). Rehabilitation following anterior
cruciate ligament injury: current recommendations for sports participation. Sports Med, 34(4), 269-280.
Lane, N. E. (1995). Exercise: a cause of
osteoarthritis. J Rheumatol Suppl, 43,
3-6.
Leach, R. E., Stryker, W. S., & Zohn, D. A.
(1965). A comparative study of isometric and isotonic quadriceps exercise
programs. J Bone Joint Surg Am, 47(7),
1421-1426.
Lohmander, L. S., & Roos, H. (1994). Knee
ligament injury, surgery and osteoarthrosis. Truth or consequences? Acta Orthop Scand, 65(6), 605-609.
Mackenzie,
R., Palmer, C. R., Lomas, D. J., & Dixon, A. K. (1996). Magnetic
resonance imaging of the knee: diagnostic performance studies. Clin Radiol, 51(4), 251-257.
Majima,
T., Yasuda, K., Tago, H., Tanabe, Y., & Minami, A. (2002). Rehabilitation
after hamstring anterior cruciate ligament reconstruction. Clin Orthop Relat Res(397), 370-380.
Marcacci,
M., Zaffagnini, S., Iacono, F., Vascellari, A., Loreti, I., Kon, E., et al. (2003).
Intra- and extra-articular anterior cruciate ligament reconstruction utilizing
autogeneous semitendinosus and gracilis tendons: 5-year clinical results. Knee Surg Sports Traumatol Arthrosc, 11(1),
2-8.
Menetrey, J., Duthon, V. B., Laumonier, T., &
Fritschy, D. (2008). "Biological failure" of the anterior cruciate
ligament graft. Knee Surg Sports
Traumatol Arthrosc.
Miklebust, G., & Bahr, R. (2005). Return to play
guidelines after anterior cruciate ligament surgery. London: Committe on
Publication Ethics Seminar.
Neyret, P., Donell, S. T., DeJour, D., & DeJour,
H. (1993). Partial meniscectomy and anterior cruciate ligament rupture in
soccer players. A study with a minimum 20-year followup. Am J Sports Med, 21(3), 455-460.
Neyret, P., Donell, S. T., & Dejour, H. (1993).
Results of partial meniscectomy related to the state of the anterior cruciate
ligament. Review at 20 to 35 years. J
Bone Joint Surg Br, 75(1), 36-40.
O´Connor, F. G., Sallis, R. E., Wilder, R. P., &
Patrick, S. P. (2004). Sports Medicine
(just the facts): McGraw Hill.
Paternostro-Sluga,
T., Fialka, C., Alacamliogliu, Y., Saradeth, T., & Fialka-Moser, V. (1999).
Neuromuscular electrical stimulation after anterior
cruciate ligament surgery. Clin Orthop
Relat Res(368), 166-175.
Pitman, M. I., Nainzadeh, N., Menche, D., Gasalberti,
R., & Song, E. K. (1992). The intraoperative evaluation of the neurosensory
function of the anterior cruciate ligament in humans using somatosensory evoked
potentials. Arthroscopy, 8(4),
442-447.
Risberg, M. A., Beynnon, B. D., Peura, G. D., &
Uh, B. S. (1999). Proprioception after anterior cruciate ligament
reconstruction with and without bracing. Knee
Surg Sports Traumatol Arthrosc, 7(5), 303-309.
Rougraff, B., Shelbourne, K. D., Gerth, P. K., &
Warner, J. (1993). Arthroscopic and histologic analysis of human patellar
tendon autografts used for anterior cruciate ligament reconstruction. Am J Sports Med, 21(2), 277-284.
Rougraff, B. T., & Shelbourne, K. D. (1999).
Early histologic appearance of human patellar tendon autografts used for
anterior cruciate ligament reconstruction. Knee
Surg Sports Traumatol Arthrosc, 7(1), 9-14.
Shawt, T. (2005). Do early quadriceps exercise affect
the outcome of ACL reconstruction?. A randomized controlled trial. Aus J Physioterapy, 51(1), 9-17.
Shelbourne, K. D., & Nitz, P. (1990). Accelerated
rehabilitation after anterior cruciate ligament reconstruction. Am J Sports Med, 18(3), 292-299.
Siegel, M. G., & Barber-Westin, S. D. (1998).
Arthroscopic-assisted outpatient anterior cruciate ligament reconstruction
using the semitendinosus and gracilis tendons. Arthroscopy, 14(3), 268-277.
Tagesson, S., Oberg, B., Good, L., & Kvist, J. (2008).
A comprehensive rehabilitation program with quadriceps strengthening in closed
versus open kinetic chain exercise in patients with anterior cruciate ligament
deficiency: a randomized clinical trial evaluating dynamic tibial translation
and muscle function. Am J Sports Med, 36(2),
298-307.
Thomson, L. C., Handol, H. H. G., & Cunningham,
A. (2005). Physiotherapist-led programmes and interventions for rehabilitation
of anterior cruciate ligament, medial collateral ligament and meniscal injuries
of the knee in adults (Review), The
Cochrane Database of Systematic Review (Vol. 2): The Cochrane Library.
Thomson, L. C., Handoll, H. H., Cunningham, A., &
Shaw, P. C. (2007). Physiotherapist-led programmes and interventions for
rehabilitation of anterior cruciate ligement, medial collateral ligament and
meniscal injuries of the knee in adults. Cochrane
Database Syst Rev, 18(2), CD001354.
Torry, M. R., Decker, M. J., Ellis, H. B., Shelburne,
K. B., Sterett, W. I., & Steadman, J. R. (2004). Mechanisms of compensating
for anterior cruciate ligament deficiency during gait. Med Sci Sports Exerc, 36(8), 1403-1412.
Trees, A. H., Howe, T. E., Dixon, J., & White, L.
(2005). Exercise for treating isolated anterior cruciate ligament injuries in
adults. Cochrane Database Syst Rev(4),
CD005316.
Trees, A. H., Howe, T. E., Grant, M., & Gray, H.
G. (2007). Exercise for treating anterior cruciate ligament injuries in
combination with collateral ligament and meniscal damage of the knee in adults.
Cochrane Database Syst Rev(3), CD005961.
Tyler, T. F., McHugh, M. P., Gleim, G. W., &
Nicholas, S. J. (1998). The effect of immediate weightbearing after anterior
cruciate ligament reconstruction. Clin
Orthop Relat Res(357), 141-148.
Williams, G. N., Barrance, P. J., Snyder-Mackler, L.,
& Buchanan, T. S. (2004). Altered quadriceps control in people with
anterior cruciate ligament deficiency. Med
Sci Sports Exerc, 36(7), 1089-1097.
Zatterstrom, R., Friden, T., Lindstrand, A., &
Moritz, U. (2000). Rehabilitation following acute anterior cruciate ligament
injuries--a 12-month follow-up of a randomized clinical trial. Scand J Med Sci Sports, 10(3), 156-163.
Zohn, D. A., Leach, R. E., & Stryker, W. S.
(1964). A Comparison of Isometric and Isotonic Exercises of the Quadriceps
after Injuries to the Knee. Arch Phys Med
Rehabil, 45, 571-574.
Rev.int.med.cienc.act.fís.deporte – vol. 8 -
número 29 - marzo 2008 - ISSN: 1577-0354