Rev.int.med.cienc.act.fís.deporte - vol. 8 - número 32 - diciembre 2008 - ISSN: 1577-0354
Calderón, F.J.; Benito, PJ.; Peinado, A.B. y Díaz, V. (2008). Significado
fisiológico de la transición aeróbica-anaeróbica. Revista Internacional de
Medicina y Ciencias de la Actividad Física y el Deporte vol. 8 (32) pp. 321-337
Http://cdeporte.rediris.es/revista/revista32/arttransicion99.htm
REVISIÓN
SIGNIFICADO FISIOLÓGICO DE LA TRANSICIÓN AERÓBICA-ANAERÓBICA
PHYSIOLOGICAL MEANING OF THE AEROBIC-ANAEROBIC TRANSITION
Calderón, F.J.1;
Benito, PJ.2; Peinado, A.B.3 y Díaz, V.4
1(franciscojavier.calderon@upm.es)
Doctor en Medicina y Cirugía. Profesor Titular de Universidad, Facultad de
Ciencias de la Actividad Física y del Deporte – INEF. Universidad Politécnica
de Madrid, España.
2(pedroj.benito@upm.es)
Doctor en Ciencias de la Actividad Física y del Deporte. Profesor Titular
Interino, Facultad de Ciencias de la Actividad Física y del Deporte – INEF.
Universidad Politécnica de Madrid, España.
3(anabelen.peinado@upm.es)
Licenciada en Ciencias de la Actividad Física y del Deporte. Becaria de
doctorado, Facultad de Ciencias de la Actividad Física y del Deporte – INEF.
Universidad Politécnica de Madrid, España.
4(victor.diaz@upm.es)
Licenciado en Ciencias de la Actividad Física y del Deporte. Técnico de Laboratorio,
Facultad de Ciencias de la Actividad Física y del Deporte – INEF. Universidad
Politécnica de Madrid, España.
RECIBIDO 2 de octubre 2008
ACEPTADO 11 de
noviembre de 2008
CLASIFICACIÓN UNESCO 2411
RESUMEN
La transición aeróbica-anaeróbica ha
sido muy estudiada, proponiéndose diversos métodos para su determinación. Estos
procedimientos se pueden dividir en ergoespirométricos y no ergoespirométricos.
Los primeros se basan en modificaciones de parámetros del intercambio
respiratorio, obteniéndose el umbral anaeróbico ventilatorio (UAventilatorio).
Los segundos se sustentan en los cambios producidos por diversos parámetros
determinados en sangre, músculo u otras secreciones (saliva). Con estos procedimientos
se obtienen los siguientes umbrales anaeróbicos: UAláctico, UAcatecolaminas,
UAEMG y UAsaliva.
A pesar de la vasta información
relativa a este fenómeno, desconocemos cuál es el mecanismo fisiológico que
permite explicar la coincidencia en el tiempo de los diferentes métodos de
determinar el UA. Consideramos que el UA constituye para el sistema nervioso
central (SNC) una situación de estrés de todo el organismo. Así, el SNC ordena un
aumento de actividad nerviosa de forma generalizada a través de sus dos
subdivisiones (somático y vegetativo). La activación simultánea de ambas
subdivisiones justificaría la coincidencia en el tiempo de métodos de
determinación del UA tan diversos y aparentemente no relacionados. Desconocemos
cuál es la información procesada y cuáles son las estructuras del SNC que intervienen.
Probablemente, la propia señal eferente propuesta para explicar el significado
fisiológico del UA, sea también la información que recibe el SNC. El hecho de
que aumente, por ejemplo, la concentración de lactato a partir del UA,
constituiría una información para el SNC sobre la situación del organismo
próxima al límite.
PALABRAS CLAVE:
umbral anaeróbico, sistema nervioso central, ventilación,
lactato.
ABSTRACT
The
aerobic-anaerobic transition has been studied along years. Several methodologies
have been proposed: ergoespirometric and non ergoespirometric. The first ones
are based on modifications of parameters of the gas exchange, obtaining the
ventilatory threshold. The next are based in the changes produces by several
parameters measured in blood, muscle or other secretions (saliva). With these
procedures the following anaerobic thresholds are obtained: lactic,
catecholamines, electromiography (EMG) and saliva.
In spite
of the great amount of information regarding this phenomenon, we do not know
which is the physiological mechanism that allows to explain the coincidence in
the time of the different methodologies to determine the anaerobic threshold.
We think that the anaerobic threshold is an alarm signal for the central
nervous system (CNS). The simultaneous activation of the subdivisions of the
CNS (somatic and vegetative) would justify the coincidence in the time of the
different anaerobic thresholds. We do not know which is the processed
information and which are the structures of the CNS that takes part. Probably,
the own efferent signal propose to explain the physiological meaning of the anaerobic
threshold, is also the information that receives the CNS. The increases of the
lactate concentration, for example, would warn the CNS that the organism is
near the limit.
KEY
WORDS: anaerobic threshold, central
nervous system, ventilation, lactate.
1. INTRODUCCIÓN
Cualquier persona
ha experimentado que subir 5 pisos determina que su corazón vaya más deprisa
(aumento de la frecuencia cardiaca (FC)) y su respiración se acelere
(incremento de la frecuencia respiratoria (FR)). Esto es lo más evidente,
aunque además se realicen otros ajustes más difíciles de percibir, tales como
el incremento del volumen sistólico (VS) o del volumen alveolar (Va). El
aumento de la FC y FR constituyen las respuestas del sistema cardiovascular y
aparato respiratorio, respectivamente. Si cualquier persona sube todos los días
3 o 4 veces los cinco pisos percibirá, al cabo del tiempo, que su corazón no
late tan deprisa y que su respiración es más lenta. Es decir, el entrenamiento
habrá desencadenado la adaptación del corazón y del aparato respiratorio. Este
ejemplo tan simple sirve para ilustrar la respuesta y adaptación al ejercicio
dinámico.
A lo largo de
la historia de la Fisiología del Ejercicio se han desarrollado diferentes
procedimientos para valorar la respuesta y adaptación del organismo (1, 2). La ergoespirometría constituye un
método estandarizado y utilizado de forma habitual en los laboratorios de
Fisiología del Ejercicio (3). La información aportada por esta
prueba es, en realidad, un compendio de la respuesta integrada del organismo al
ejercicio dinámico, pues permite conocer el funcionamiento del sistema
cardiovascular, aparato respiratorio y de forma indirecta, del metabolismo (4, 5). De los parámetros obtenidos en una
prueba de esfuerzo, los más importantes, desde un punto de vista práctico son:
el consumo de oxígeno máximo (VO2 máx.) y la transición aeróbica
anaeróbica. La importancia de estos dos parámetros radica en dos hechos: 1º)
desde el punto de vista teórico, para intentar explicar el funcionamiento del
organismo en condiciones límite; 2º) desde el punto de vista práctico, debido a
que muchos de los fundamentos del entrenamiento se basan en conocer estos dos
parámetros.
Fisiológicamente,
el VO2 máx. constituye el parámetro "central" de una
prueba ergoespirométrica, pues es el más representativo del funcionamiento
global del organismo, ya que integra la función de múltiples aparatos y
sistemas (sistema cardiovascular, aparato respiratorio, transporte sanguíneo de
los gases y metabolismo). Cuando un deportista se encuentra en una situación
real, intenta llevar una intensidad de ejercicio lo más próxima a su VO2
máx. Por lo tanto, adquiere especial relevancia medir cuánto es capaz el
organismo de acercarse al límite del rendimiento, intentando aguantar el máximo
tiempo posible. Sin embargo, parece natural pensar que el “límite fisiológico”
no se pueda mantener durante mucho tiempo. Por este motivo, a lo largo de los
años ha adquirido gran importancia conocer cuánto tiempo se puede sostener un
ejercicio dinámico lo más próximo al VO2 máx. Como la capacidad para
mantener un ejercicio prolongado se relaciona estrechamente con el metabolismo,
los investigadores pensaron que el “limite” se relacionaba con el momento en el
que el metabolismo pasaba de una situación aeróbica a anaeróbica. A este
momento se le conoce como transición aeróbica-anaeróbica (2, 6-8). Aunque
el término utilizado de forma más habitual es el de umbral anaeróbico, desde el
punto de vista de concepción del fenómeno, es preferible denominarlo transición
aeróbica-anaeróbica. El término umbral supone un valor bien delimitado, como si
fuera el dintel de una puerta, mientras que el término transición sugiere un
camino, que se acerca más a la realidad. Además, la existencia de “dos
umbrales” es un argumento más para que se entienda como zona y no como umbral.
No obstante, a efectos prácticos y de simplificación, en esta revisión
adoptaremos el término genérico de umbral anaeróbico (UA) para referirnos al
segundo umbral ventilatorio (VT2).
La importancia del
UA ha determinado que, durante muchos años, el esfuerzo de los investigadores
haya ido dirigido a proponer métodos para su determinación (2, 6, 9). En la
actualidad, los procedimientos incruentos para la determinación del UA se encuentran
considerablemente estandarizados, de manera que en los sistemas automatizados
se han desarrollado programas informáticos específicos. Sin embargo,
paradójicamente, como el momento de “cambio metabólico” es un fenómeno
fisiológicamente muy complejo, los procedimientos también lo son. El objetivo
de este trabajo es ofrecer una visión pedagógica de este fenómeno fisiológico
tan complejo, realizando una revisión de la literatura científica publicada al
respecto.
2. EXPLICACIÓN FISIOLÓGICA
DE LOS PROCEDIMIENTOS DE DETERMINACIÓN DE LA TRANSICIÓN AERÓBICA-ANAERÓBICA
Los métodos o
procedimientos de determinación del UA se pueden dividir en: 1) métodos
ergoespirométricos y 2) métodos no ergoespirométricos. Los primeros son
referidos a los que se obtienen mediante diferentes parámetros del intercambio
gaseoso. Los segundos son los que valoran el UA a través de diferentes
parámetros analizados en sangre, músculo u otros líquidos orgánicos. Aunque
existe controversia, es necesario tener presente que los dos métodos están
fisiológicamente relacionados. Algunos autores mantienen que los parámetros ergoespirométricos se
relacionan estrechamente con parámetros metabólicos o de otra índole (8). Por el contrario, Brooks (1985) opina
que son fenómenos aislados aunque relacionados (10). El objetivo de este epígrafe es dar
una explicación fisiológica global e integrada de todos los métodos destinados
a detectar el UA.
2.1. Relación fisiológica entre
los diferentes procedimientos de determinación del UA.
2.1.1. Umbral anaeróbico ventilatorio (UAventilatorio)
Diferentes parámetros del intercambio gaseoso han sido
empleados para determinar los umbrales ventilatorios (9). De forma general, se
determinan cuando las variables de intercambio respiratorio experimentan una
modificación en su respuesta. El problema de los diferentes métodos estriba en el considerable
componente de subjetividad. Al ser métodos visuales, es un aspecto importante
la manera en la que el investigador “observa” las variaciones que se producen
en el comportamiento de los diferentes parámetros. Para eliminar dicho
componente de subjetividad, algunos autores han propuesto procedimientos
matemáticos (11, 12) o bien la combinación de diferentes
métodos (13).
Todos los parámetros del intercambio gaseoso pulmonar empleados en la
determinación del UA (ventilación, equivalentes respiratorios para el oxígeno
y para el dióxido de carbono, etc.) están directamente relacionados con los mecanismos de regulación de la
respiración. Teniendo en cuenta que el control respiratorio tiene lugar, de
forma general, en el encéfalo, el significado funcional de los cambios
producidos en las variables señaladas a partir del UA es doble: 1. Constituiría
la “señal eferente” enviada por los centros de regulación de la respiración,
como resultado de detectar una situación
de alarma para la homeostasis. 2. Sería
la “señal aferente” enviada por diversos receptores (pulmonares y
extrapulmonares), para que los centros de regulación de la respiración
respondieran de “forma exagerada”.
2.1.2. Umbral anaeróbico láctico (UAláctico)
Como el organismo responde ante
el estrés que supone el ejercicio físico de forma integrada, muchos
investigadores han encontrado relaciones entre el UA determinado por
ergoespirometría y la “tendencia” de muchos otros parámetros. En plasma, el
parámetro que más se ha estudiado ha sido el lactato. De hecho, para algunos
investigadores es el patrón oro con el que se comparan otros métodos, aunque ha
sido y es origen de gran controversia. Las razones de la controversia,
relacionadas entre sí, son: 1. De carácter metodológico, pues se
requiere la extracción de sangre y la determinación de la concentración de
lactato. 2. De carácter fisiológico, pues la concentración de lactato es el
resultado de la relación producción/eliminación (14).
Atendiendo a las
características histoquímicas y bioquímicas de las fibras musculares, el
aumento de la producción de lactato se explica cuando se produce una mayor
activación de las fibras musculares tipo II. Teniendo en cuenta los conceptos
de unidad motora y orden de reclutamiento, la activación de las fibras tipo II
tendría lugar de forma preferente a partir del UA. El aumento del lactato en
plasma influye en la modificación del estado ácido-base. Así, a partir del UA,
se produce un aumento de la concentración de protones ([H+]), así
como variaciones en los parámetros fisico-químicos que determinan el estado
ácido base. Algunos autores han propuesto que se puede determinar el UA
mediante parámetros del estado ácido-base, para conocer el momento de la
transición metabólica (15, 16).
2.1.3. Umbral anaeróbico
electromiográfico (UAEMG)
En razón a lo expuesto,
algunos investigadores han intentado, mediante métodos incruentos (EMG:
electromiografía de superficie), detectar la mayor actividad de las fibras tipo
II. La EMG ha sido
utilizada para determinar la frecuencia de estimulación de las unidades
motoras. Moritani y col. (1982) y posteriormente otros investigadores (17-22) que han utilizado esta técnica, han
demostrado un cambio en la actividad electromiográfica integrada durante la
transición aeróbica-anaeróbica. Al valor umbral detectado mediante EMG se le ha
denominado umbral electromiográfico.
2.1.4. Umbral anaeróbico de catecolaminas (UAcatecolaminas)
Algunos
investigadores han propuesto que a partir del UA se produce un incremento desproporcionado
de la concentración de catecolaminas en sangre (23-25). Además, este aumento se
relaciona estrechamente con otros procedimientos para la determinación del UA.
Al valor a partir del cual se produce un aumento de la concentración de
catecolaminas en plasma se le denomina umbral de catecolaminas.
2.1.5. Umbral anaeróbico de saliva (UAsaliva).
También se ha estudiado el
comportamiento de la concentración de iones o moléculas orgánicas en
determinados líquidos corporales en el momento de la transición
aeróbica-anaeróbica. Concretamente, las variaciones de lactato u otros iones o
moléculas observadas en la saliva, ha sido un método propuesto por diferentes
investigadores (26-29). La base fisiológica del UA mediante la
composición de la saliva no es inédita, pues ya en 1963, Salminen y Kontinen
describieron las modificaciones de la misma durante el ejercicio (30). Se ha
demostrado que existe una buena correlación entre el lactato plasmático y el de
la saliva, y entre la variación de la concentración de cloro ([Cl-])
y sodio ([Na+]) y los parámetros del intercambio gaseoso.
2.1.6. Umbral anaeróbico de la
frecuencia cardiaca (UAFC)
Conconi y col. han sostenido que la relación lineal frecuencia cardiaca
(FC)/intensidad no presenta la misma pendiente a lo largo de una prueba de
esfuerzo incremental (31, 32). El punto donde se produce un cambio de la pendiente
se relaciona, según estos autores, con el UA. Desde el punto de vista del
control del entrenamiento, las expectativas que este método abrió fueron
considerables, pues bastaría con registrar la FC en una prueba de campo. Sin
embargo, existe controversia en relación al método (31-37).
El UA
determinado mediante la FC tiene cierta coherencia fisiológica. Parece lógico
pensar que, en un momento dado, los centros nerviosos para el control
cardiovascular desencadenen una respuesta distinta de la actividad vegetativa
sobre el nódulo marcapasos. El resultado sería el cambio de pendiente en la
relación FC/intensidad a partir del UA. A diferencia de la frecuencia
respiratoria que aumenta desproporcionadamente, la FC sigue aumentando hasta el
máximo, pero en menor magnitud. La razón puede ser el hecho de que el aumento
de la FC condicione la duración del ciclo cardiaco, principalmente la diástole.
Así, un incremento mayor de la FC a partir del UA podría comprometer el llenado
ventricular, de manera que los centros de regulación cardiovascular disminuyen
su actividad sobre el nodo sinusal.
2.2. Significado
fisiológico de los métodos de determinación del UA
De forma general, la respuesta de las
variables ergoespirométricas presenta dos estadios o fases, que se pueden
denominar como: lineal y no lineal. La fase lineal representa la
proporcionalidad del organismo ante el estrés que supone el ejercicio. Por
ejemplo, a mayor demanda más elevados son el gasto cardiaco y la ventilación
alveolar. Por el contrario, la fase denominada no lineal implica que la
respuesta del organismo es más elevada que las necesidades. Por ejemplo, a
partir del UA, la ventilación es mayor que el aprovechamiento que se puede
realizar.
La linealidad del VO2 y de la
producción de dióxido de carbono (VCO2) se explica por el aumento de
actividad del aparato respiratorio, sistema cardiovascular y capacidad de
transporte de los gases respiratorios. Durante la fase de linealidad, el
organismo suministra el oxígeno suficiente a las mitocondrias del tejido
muscular, de manera que éstas pueden oxidar el combustible, principalmente
carbohidratos. Al mismo tiempo, extrae el dióxido de carbono que se elimina a
la atmósfera. La relación de intercambio gaseoso (CR) se encuentra próxima a la
unidad.
El cambio o modificación de la respuesta
lineal a partir del UA, como se ha señalado anteriormente, se relaciona
estrechamente con la modificación del metabolismo. En términos sencillos, se
puede decir que la respuesta no lineal representa el paso del metabolismo
aeróbico al anaeróbico: el organismo no aporta el oxígeno suficiente al
músculo. Así, parte del piruvato no puede oxidarse en las mitocondrias y se
reduce a lactato, evitando que el potencial redox del citosol aumente de forma
considerable. Al mismo tiempo, los sistemas de eliminación comienzan a perder
eficiencia en relación a la producción. La respuesta no lineal de las
diferentes variables ergoespirométricas se podría justificar en base a los
mecanismos de regulación cardiovascular y respiratoria.
¿Cuál es el mecanismo fisiológico que
permite explicar la aparente coincidencia en el tiempo de los diferentes
métodos de determinación del UA? De forma elemental, el UA constituye para el
sistema nervioso central (SNC) una situación de estrés, al igual que para el
organismo en su conjunto. Así, el SNC “ordena” un aumento de actividad que es
enviada a través del sistema nervioso periférico (SNP). Como los nervios
espinales contienen fibras nerviosas tanto del sistema nervioso somático como
del sistema nervioso vegetativo, el resultado es una actividad simultánea de
ambas subdivisiones del SNP. Por lo tanto, la mayor actividad de ambos sistemas
justificaría (figura 1): la activación de las unidades motoras FT (fast twich),
que se traduciría en el UAEMG y secundariamente en la mayor
producción de lactato (UAláctico); la mayor actividad de los centros
de regulación de la respiración, que se traduciría en el UAventilatorio;
la activación vegetativa generalizada que sería responsable del UAcatecolaminas
y del UAsaliva y la menor activación de los centros de regulación
cardiovascular, que se traduciría en el UAFC.
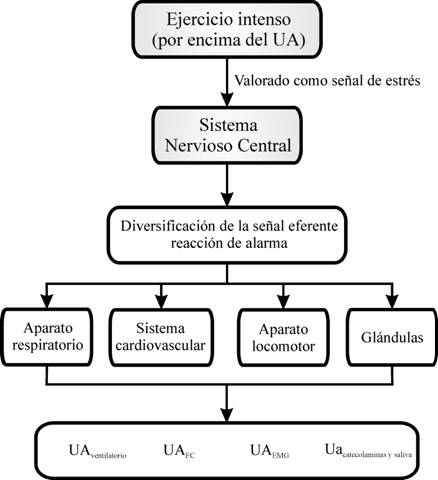
Figura 1.
Mecanismo
fisiológico propuesto para explicar la aparente coincidencia en el tiempo de
los diferentes métodos de determinación del UA.
El sistema nervioso respondería al
estrés que supone el ejercicio intenso mediante una doble activación:
córtico-adrenal y simpático-adrenal. Sin embargo, esta visión integrada es de
compleja comprobación experimental. Algunas de las preguntas que surgen al
respecto son: ¿cómo se produce el aumento de la activación simpático-adrenal a
partir del UA?, ¿qué estructuras del SNC intervienen?, ¿qué tipo de información
procesa el SNC para “modificar” la respuesta a partir del UA?, etc. Alguna de
estas preguntas podría ser contestada, en parte, en función del conocimiento
fisiológico que se tiene del concepto de estrés. Por lo tanto, esta visión
integrada del UA se limita a señalar que únicamente conocemos la “señal de
salida”, que se traduce en una coincidencia en el tiempo del UAventilatorio,
UAláctico, UAEMG, UAcatecolaminas y UAsaliva.
3. MECANISMO INTEGRADOR DE
LA RESPUESTA DEL ORGANISMO
La diversificación de la señal
eferente es, probablemente, la forma de poner en alerta a la totalidad del
organismo. En términos de Seyle, la respuesta del organismo a partir del UA es
inespecífica, como sucede en otras formas de estrés. Esta respuesta se ha
mantenido a lo largo de la evolución. Se desconocen las señales que recibe el
SNC a la hora de elaborar una respuesta múltiple y qué centros nerviosos
elaboran, dirigen y coordinan una señal eferente tan compleja.
3.1. ¿Qué estructuras del
SNC intervienen durante el ejercicio intenso? ¿Qué tipo de información procesa
el SNC para modificar la respuesta a partir del UA?
El hecho de que a partir del UAEMG
se sugiera una activación de las unidades motoras tipo FT, puede hacer pensar
que la médula espinal pudiera ser un centro nervioso de elaboración de la
respuesta. Asimismo, el hecho de que aumente la ventilación (UAventilatorio)
puede ser debido a que los centros bulbares que intervienen en la regulación de
la respiración, elaboren la respuesta. Finalmente, la respuesta del organismo
al ejercicio intenso es llevada a cabo por los sistemas simpático-adrenal e
hipofisario-adrenal, de manera que los centros nerviosos que coordinan ambos
podrían ser los responsables del UAcatecolaminas y del UAsaliva.
Es decir, siguiendo un orden caudo-craneal, podríamos pensar que los centros
nerviosos de elaboración estarían situados en las estructuras nerviosas
derivadas del mesencéfalo primitivo. Los centros nerviosos del tronco encefálico
y médula espinal estarían subordinados a los anteriores.
Por otra parte, para explicar la
activación de las unidades motoras tipo FT (UAEMG)
que permitirían dar respuesta al aumento
de la concentración de lactato (UAláctico), es necesario que de
forma simultánea a la activación hipofisaria-adrenal y simpático-adrenal, se
produzca un cambio en el orden de reclutamiento, a través de las vías motoras
descendentes que actúan sobre la vía final común. Los sistemas eferentes de los
centros supraespinales, al actuar sobre las motoneuronas espinales,
desencadenan la excitación de las unidades motoras de diferente umbral, de
manera que pueden estimular a las de mayor valor (unidades FT) e inhibir las
del menor valor (unidades ST – slow twich).
Además, a nivel de la médula espinal
también se puede ejercer control sobre el reclutamiento. Las características
electrofisiológicas de las motoneuronas del asta anterior permiten una
activación secuencial de las mismas. El
principio del tamaño determina que exista una relación inversa entre la
resistencia de la membrana de las motoneuronas y el tamaño del soma. También,
se ha sugerido que las poblaciones de unidades motoras pueden activarse de
forma diferente, siguiendo órdenes de reclutamiento distintas. Esto permitiría
la activación de toda una población de unidades motoras y evitar la saturación
de unidades con un bajo nivel de activación, permitiendo que respondieran
rápidamente a las influencias espinales y supraespinales. Por lo tanto, el
sistema motor integrado por los centros de elaboración, vías nerviosas y
unidades motoras, se encargaría de enviar la señal eferente necesaria, que
coincidiría con el UAEMG y el UAláctico.
Mayor dificultad entraña la segunda
pregunta. Al ser la señal eferente tan extensa, parece lógico pensar que,
igualmente, las señales aferentes a los centros nerviosos sean también
múltiples. Es muy probable que la información a los centros nerviosos que
coordinan la respuesta al ejercicio proceda de: receptores cinestésicos,
receptores del sistema cardiovascular y receptores del aparato respiratorio (38-40).
En resumen, la activación simultánea de
los sistemas que se encargan de la coordinación vegetativa (hipofisario-adrenal
y simpático-adrenal) y del sistema motor, justificaría la coincidencia en el
tiempo de métodos de determinación del UA tan diversos y aparentemente no
relacionados (UAventilatorio, UAláctico, UAEMG,
UAcatecolaminas y UAsaliva).
3.2. Sentido
fisiológico del mecanismo integrador
Es probable que a partir de cierta
intensidad la información que llega al SNC sirva para que interprete que todos
los órganos y sistemas se encuentran muy próximos a su límite máximo. Por
ejemplo, consideremos uno de los parámetros más comúnmente utilizados para
conocer que se ha llegado al máximo: la FC. Aunque puede ser objeto de debate,
una forma muy sencilla de conocer el límite máximo cardiaco es restarle a 220
la edad de una persona. Al valor obtenido se le denomina FC máxima teórica.
Teniendo en cuenta que el UA se alcanza alrededor del 80 % de la FC máxima
teórica, siendo el margen para alcanzar el máximo un 20 %. Al igual que otras
señales de alarma, como la sed o el hambre, el organismo debe conocer cuánto
margen tiene antes de que peligre su homeostasis (41-45).
Por lo tanto, probablemente las
diferentes señales enviadas por el SNC durante el UA sirven, además, como señal
de retroalimentación. Así, el aumento de la concentración de lactato,
catecolaminas y el incremento ventilatorio, por ejemplo, constituirían señales
para que el SNC conozca que se está alcanzando el máximo. Como el límite para realizar ejercicio intenso es
multifactorial, parece coherente que la información para detectarlo también lo
sea. De forma general, la limitación para realizar ejercicio puede venir
condicionada por: una incapacidad del sistema cardiovascular y aparato
respiratorio para suministrar el oxígeno y eliminar el dióxido de carbono en
relación a la demanda metabólica de los tejidos; y una incapacidad de
utilización de los sustratos energéticos. Ambas
condiciones se encuentran íntimamente ligadas y quedan reflejadas en la figura
2. Aunque es discutible cuál es la función fisiológica limitante para realizar
ejercicio máximo, parece que el responsable puede ser el sistema
cardiovascular.
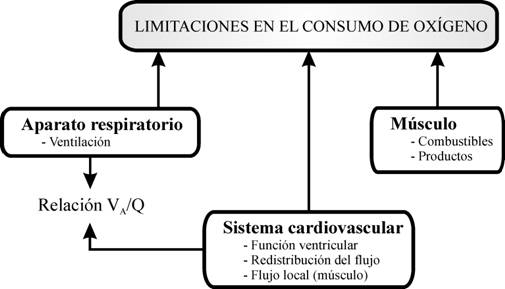
Figura 2. Limitantes del consumo de oxígeno.
Si el UA es considerado como una
señal de alarma para la integridad del organismo, ¿cambia con el entrenamiento? Durante muchos años, los entrenadores
han depositado muchas expectativas en la importancia práctica del UA. Se
pensaba que, en personas muy entrenadas, el VO2 máx. apenas se
modificaba y que los resultados en la mejora del rendimiento se podían explicar
por la modificación del UA. En nuestra opinión, en personas muy entrenadas, el
UA es tan poco modificable como el VO2 máx. La razón estriba,
precisamente, en la consideración del UA como señal de alarma. Mucho ha sido el
esfuerzo dedicado a conocer las modificaciones del VO2 máx. durante
el proceso entrenamiento, pero más limitados han sido los estudios encaminados
a conocer el desplazamiento del UA con este proceso. Las diferencias
encontradas para el VO2 máx. oscilan entre el 4 y el 33 %, debido a:
estado previo de entrenamiento, programa de entrenamiento (intensidad,
duración, frecuencia y método) y herencia (46).
En la tabla 1 se presentan los
diferentes estudios que han analizado la evolución de la transición
aeróbica-anaeróbica, que experimenta una oscilación considerable cuando este
proceso se encuentra al inicio (umbral ventilatorio 1: VT1) y un
menor porcentaje de adaptación cuando el metabolismo adquiere un predominio
anaeróbico (umbral ventilatorio 2: VT2). No obstante, en la mayor
parte de los estudios las diferencias no eran significativas. Como el nivel de
resistencia de los deportistas estudiados era muy variable, las diferencias del
UA también lo eran. Así, las diferencias para el VT1 oscilan entre el 0,5 y el
22 % y las diferencias para el VT2 son del 2,5 al 12,8 %. También se observa
que cuanto más entrenada es la población objeto de estudio, menor es el
desplazamiento del UA (46).
|
|
I |
II |
III |
IV |
|
|
Berg,
K (47) |
Umbral láctico (mmol·L-1) |
8,1 ± 0,4 |
8,2 ± 0,3 |
|
|
|
Zapico,
AG (ciclistas) (48) |
Umbral láctico (mmol·L-1) |
11,3 ± 1,1 |
12 ± 1,1 |
11 ± 1 |
|
|
VT1 (% VO2 máx.) |
52 ± 2,1 |
60 ± 1,8 |
62 ± 1,7 |
|
|
|
VT2 (% VO2 máx.) |
82,5 ± 1,7 |
87,9 ± 1 |
90,1 ± 1,4 |
|
|
|
Zapico,
AG (triatletas) (49) |
Umbral láctico (mmol·L-1) |
12,1 ± 1,4 |
10,3 ± 1,4 |
14,1 ± 1,3 |
|
|
VT1 (% VO2 máx.) |
50 ± 2,5 |
61 ± 2,1 |
56 ± 2 |
|
|
|
VT2 (% VO2 máx.) |
83,2 ± 2 |
83,2 ± 1,2 |
86,2 ± 1,6 |
|
|
|
Koutedakis, Y (50) |
VT2 (% VO2 máx.) |
85,4 ± 5,2 |
82,2 ± 5,2 |
76,9 ± 4,2 |
|
|
Pardo, FJ (51) |
Umbral láctico (mmol·L-1) |
7,9 ± 0,5 |
8,1 ± 0,5 |
6,7 ± 0,5 |
|
|
VT1 (% VO2 máx.) |
71,6 ± 1,3 |
72 ± 1,5 |
73,1 ± 1,3 |
|
|
|
VT2 (% VO2 máx.) |
88,7 ± 0,8 |
86,7 ± 1,1 |
89,2 ± 1,1 |
|
|
|
Svedenhag, J (52) |
VT2 (% VO2 máx.) |
85,9 ± 1,3 |
85,6 ± 1,3 |
82,8 ± 1,1 |
85,2 ± 1,2 |
|
Tanaka, K (53) |
VT1 (% VO2 máx.) |
75,1 ± 5,5 |
74,5 ± 5,2 |
74,5 ± 3,5 |
|
|
White, JA (54) |
VT1 (W) |
281 ± 29,9 |
317 ± 29,1 |
|
|
|
VT2 (W) |
518 ± 37,5 |
557 ± 38,5 |
|
|
|
|
Yuan, Y (55) |
VT1 (% VO2 máx.) |
62,2 ± 5,6 |
56,9 ± 7,2 |
63,5 ± 4,7 |
|
|
VT2 (% VO2 máx.) |
76 ± 5,9 |
76 ± 4,8 |
78,6 ± 6,4 |
|
|
Tabla 1. Parámetros de la transición
aeróbica-anaeróbica (umbrales ventilatorios o umbral láctico) a lo largo de una
temporada.
Parece lógico pensar que cuando un
deportista se encuentre en el momento óptimo de forma, sus variables
fisiológicas se encuentren al límite de la mejora. ¿Cuál puede ser la razón o
razones que expliquen la estabilización del UA? Al ser considerado como una
señal de alarma, las variaciones que pueda experimentar están sujetas a muchos
parámetros difíciles de controlar, referidos al mecanismo fisiológico del
estrés. Además, los diferentes métodos son muy rudimentarios para determinar
ligeros matices de adaptación en personas muy entrenadas.
4. CONCLUSIONES
Con lo visto
hasta ahora, considerar el UA como una señal de alarma parece lógico si tenemos
en cuenta la respuesta integrada del organismo y no de sus partes de forma
aislada. Aunque este aspecto aún requiere una mayor evidencia científica, ya
son varios los trabajos que demuestran una influencia clara del SNC sobre la
regulación del ejercicio (39, 40, 56-59). Por lo tanto,
aunque esta revisión expresa en muchos casos un punto de vista personal, ésta
suposición no debe ser descartada a
priori, sino que debe animar a los investigadores ponerla a prueba como
hipótesis.
REFERENCIAS BIBLIOGRÁFICAS
1. Breuer HW. Cardiopulmonary exercise tests
- proposals for standardization and interpretation. Pneumologie. 2004
Aug;58(8):553-65.
2. Hollmann W. Historical remarks on the development of the
aerobic-anaerobic threshold up to 1966. Int J Sports Med. 1985 Jun;6(3):109-16.
3. Taylor HL, Wang Y, Rowell L, Blomqvist G. The Standardization
and Interpretation of Submaximal and Maximal Tests of Working Capacity. Pediatrics. 1963 Oct;32:SUPPL
703-22.
4. Calderón
FJ, Benito PJ. Ergoespirometría: paradigma del análisis de la respuesta
integrada al ejercicio dinámico. Selección. 2001;10(1):21-36.
5. Calderon
FJ, Benito PJ, García A. Aplicación práctica de las pruebas de esfuerzo. Selección.
2002;11(4):202-9.
6. Hollmann W. 42 years ago--development of the concepts of
ventilatory and lactate threshold. Sports Med. 2001;31(5):315-20.
7. Wasserman K. The anaerobic threshold: definition,
physiological significance and identification. Adv Cardiol. 1986;35:1-23.
8. Wasserman K, Beaver WL, Whipp BJ. Gas exchange theory and the
lactic acidosis (anaerobic) threshold. Circulation. 1990 Jan;81(1
Suppl):II14-30.
9. Svedahl K, MacIntosh BR. Anaerobic threshold: the concept and
methods of measurement. Can J Appl Physiol. 2003 Apr;28(2):299-323.
10. Brooks GA. Anaerobic threshold: review of the concept and
directions for future research. Med Sci Sports Exerc. 1985 Feb;17(1):22-34.
11. Wasserman K. Anaerobiosis, lactate, and gas exchange during
exercise: the issues. Fed Proc. 1986 Dec;45(13):2904-9.
12. Wasserman K, Whipp BJ, Koyl SN, Beaver WL. Anaerobic threshold
and respiratory gas exchange during exercise. J Appl Physiol. 1973
Aug;35(2):236-43.
13. Gaskill SE, Ruby BC, Walker AJ, Sanchez OA, Serfass RC, Leon AS.
Validity and reliability of combining three methods to determine ventilatory
threshold. Med Sci Sports Exerc. 2001 Nov;33(11):1841-8.
14. Billat VL, Sirvent P, Py G, Koralsztein JP, Mercier J. The
concept of maximal lactate steady state: a bridge between biochemistry,
physiology and sport science. Sports Med. 2003;33(6):407-26.
15. Iwanaga K, Sakurai M, Minami T, Kato Y, Sairyo K, Kikuchi Y. Is
the intracellular pH threshold an anaerobic threshold from the view point of
intracellular events?: a brief review. Appl Human Sci. 1996 Mar;15(2):59-65.
16. Loat CE, Rhodes EC. Relationship between the lactate and
ventilatory thresholds during prolonged exercise. Sports Med. 1993
Feb;15(2):104-15.
17. Moritani T, Nagata A, Muro M. Electromyographic manifestations
of muscular fatigue. Med Sci Sports Exerc. 1982;14(3):198-202.
18. Helal JN, Guezennec CY, Goubel F. The aerobic-anaerobic
transition: re-examination of the threshold concept including an
electromyographic approach. Eur J Appl Physiol Occup Physiol. 1987;56(6):643-9.
19. Hug F, Laplaud D, Lucia A, Grelot L. A comparison of visual and
mathematical detection of the electromyographic threshold during incremental
pedaling exercise: a pilot study. J Strength Cond Res. 2006 Aug;20(3):704-8.
20. Jurimae J, von Duvillard SP, Maestu J, Cicchella A, Purge P,
Ruosi S, et al. Aerobic-anaerobic transition intensity measured via EMG signals
in athletes with different physical activity patterns. Eur J Appl Physiol. 2007
Oct;101(3):341-6.
21. Mateika JH, Duffin J. The ventilation, lactate and
electromyographic thresholds during incremental exercise tests in normoxia,
hypoxia and hyperoxia. Eur J Appl Physiol Occup Physiol. 1994;69(2):110-8.
22. Matsumoto T, Ito K, Moritani T. The relationship between
anaerobic threshold and electromyographic fatigue threshold in college women.
Eur J Appl Physiol Occup Physiol. 1991;63(1):1-5.
23. Siciliano G, Pasquali L, Manca ML, Del Corona A, Tessa A,
Patrono C, et al. The relationship between anaerobic lactate threshold and
plasma catecholamines during incremental exercise in hereditary spastic
paraplegia. Funct Neurol. 2003 Apr-Jun;18(2):83-7.
24. Tanabe K, Osada N, Noda K, Yamamoto M, Omiya K, Itoh H, et al.
Changes in hemodynamics and catecholamines during single-level exercise at the
anaerobic threshold and 120% of the anaerobic threshold in normal subjects. J
Cardiol. 1994 Jan-Feb;24(1):61-9.
25. Urhausen A, Weiler B, Coen B, Kindermann W. Plasma
catecholamines during endurance exercise of different intensities as related to
the individual anaerobic threshold. Eur J Appl Physiol Occup Physiol.
1994;69(1):16-20.
26. Calvo F, Chicharro JL, Bandres F, Lucia A, Perez M, Alvarez J,
et al. Anaerobic threshold determination with analysis of salivary amylase. Can
J Appl Physiol. 1997 Dec;22(6):553-61.
27. Chicharro JL, Legido JC, Alvarez J, Serratosa L, Bandres F,
Gamella C. Saliva electrolytes as a useful tool for anaerobic threshold
determination. Eur J Appl Physiol Occup Physiol. 1994;68(3):214-8.
28. Chicharro
JL, Lucia A, Perez M, Vaquero AF, Urena R. Saliva composition and exercise. Sports Med. 1998
Jul;26(1):17-27.
29. Segura R, Javierre C, Ventura JL, Lizarraga MA, Campos B,
Garrido E. A new approach to the assessment of anaerobic metabolism:
measurement of lactate in saliva. Br J Sports Med. 1996 Dec;30(4):305-9.
30. Salminen S, Kontinen A. Effect of exercise on Na and K
concentrations in human saliva and serum. J Appl Physiol. 1963 Jul;18:812-4.
31. Conconi F, Ferrari M, Ziglio PG, Droghetti P, Codeca L.
Determination of the anaerobic threshold by a noninvasive field in man. Boll
Soc Ital Biol Sper. 1980 Dec 15;56(23):2504-10.
32. Conconi F, Grazzi G, Casoni I, Guglielmini C, Borsetto C,
Ballarin E, et al. The Conconi test: methodology after 12 years of application.
Int J Sports Med. 1996 Oct;17(7):509-19.
33. Debray P, Dey SK. A comparison of the point of deflection from
linearity of heart rate and the ventilatory threshold in the determination of
the anaerobic threshold in Indian boys. J Physiol Anthropol. 2007
Jan;26(1):31-7.
34. Glass C, Knowlton RG, Sanjabi PB, Sullivan JJ. The effect of
exercise induced glycogen depletion on the lactate, ventilatory and
electromyographic thresholds. J Sports Med Phys Fitness. 1997 Mar;37(1):32-40.
35. Grazzi G, Casoni I, Mazzoni G, Manfredini F, Uliari S, Conconi
F. On the methodology of the Conconi test. Int J Sports Med. 2005
Jun;26(5):397-8; author reply 9.
36. Grazzi G, Casoni I, Mazzoni G, Uliari S, Conconi F. Protocol for
the Conconi test and determination of the heart rate deflection point. Physiol
Res. 2005;54(4):473-5.
37. Grazzi G, Mazzoni G, Casoni I, Uliari S, Collini G, Heide L, et
al. Identification of a Vo2 deflection point coinciding with the heart rate
deflection point and ventilatory threshold in cycling. J Strength Cond Res.
2008 Jul;22(4):1116-23.
38. Amann M, Dempsey JA. Locomotor muscle fatigue modifies central
motor drive in healthy humans and imposes a limitation to exercise performance.
The Journal of physiology. 2008 Jan 1;586(1):161-73.
39. Amann M, Eldridge MW, Lovering AT, Stickland MK, Pegelow DF,
Dempsey JA. Arterial oxygenation influences central motor output and exercise
performance via effects on peripheral locomotor muscle fatigue in humans. The
Journal of physiology. 2006 Sep 15;575(Pt 3):937-52.
40. Amann M, Proctor LT, Sebranek JJ, Eldridge MW, Pegelow DF,
Dempsey JA. Somatosensory feedback from the limbs exerts inhibitory influences
on central neural drive during whole body endurance exercise J Appl Physiol.
2008;doi:10.1152/japplphysiol.90456.2008.
41. Noakes TD. Physiological models to understand exercise fatigue
and the adaptations that predict or enhance athletic performance. Scandinavian
journal of medicine & science in sports. 2000 Jun;10(3):123-45.
42. Noakes TD, St Clair Gibson A, Lambert EV. From catastrophe to
complexity: a novel model of integrative central neural regulation of effort
and fatigue during exercise in humans. British journal of sports medicine. 2004
Aug;38(4):511-4.
43. Noakes TD, St Clair Gibson A, Lambert EV. From catastrophe to
complexity: a novel model of integrative central neural regulation of effort
and fatigue during exercise in humans: summary and conclusions. British journal
of sports medicine. 2005 Feb;39(2):120-4.
44. St Clair Gibson A, Noakes TD. Evidence for complex system
integration and dynamic neural regulation of skeletal muscle recruitment during
exercise in humans. British journal of sports medicine. 2004 Dec;38(6):797-806.
45. Ulmer HV. Concept of an extracellular regulation of muscular
metabolic rate during heavy exercise in humans by psychophysiological feedback.
Experientia.
1996 May 15;52(5):416-20.
46. Benito PJ, Peinado AB, Diaz V, Lorenzo I, Calderon FJ. Evolución de los parámetros
ergoespirométricos con el entrenamiento en deportistas. Archivos de
Medicina del Deporte. 2008;XXIV(6):464-75.
47. Berg K. Endurance training and performance in runners: research
limitations and unanswered questions. Sports Med. 2003;33(1):59-73.
48. Zapico AG, Calderon FJ, Benito PJ, Gonzalez CB, Parisi A,
Pigozzi F, et al. Evolution of physiological and haematological parameters with
training load in elite male road cyclists: a longitudinal study. J Sports Med Phys Fitness. 2007
Jun;47(2):191-6.
49. Zapico AG.
Evolución comparada de los parámetros fisiológicos en triatletas y ciclistas de
élite, a lo largo de una temporada. Madrid: Universidad Politécnica de Madrid; 2004.
50. Koutedakis Y. Seasonal variation in fitness parameters in
competitive athletes. Sports Med. 1995 Jun;19(6):373-92.
51. Pardo FJ.
Evolución de los parámetros fisiológicos en ciclistas profesionales a lo largo
de una temporada. Madrid: Universidad Politécnica de Madrid; 2001.
52. Svedenhag J, Sjodin B. Physiological characteristics of elite
male runners in and off-season. Can J Appl Sport Sci. 1985 Sep;10(3):127-33.
53. Tanaka K, Matsuura Y, Matsuzaka A, Hirakoba K, Kumagai S, Sun
SO, et al. A longitudinal assessment of anaerobic threshold and
distance-running performance. Med Sci Sports Exerc. 1984 Jun;16(3):278-82.
54. White JA, Quinn G, Al-Dawalibi M, Mulhall J. Seasonal changes in
cyclists' performance. Part I. The British Olympic road race squad. Br J Sports
Med. 1982 Mar;16(1):4-12.
55. Yuan Y, Chan KM. A longitudinal study on the ammonia threshold
in junior cyclists. Br J Sports Med. 2004 Apr;38(2):115-9.
56. Green AL, Paterson DJ. Identification of neurocircuitry
controlling cardiovascular function in humans using functional neurosurgery:
implications for exercise control. Exp Physiol. 2008 Sep;93(9):1022-8.
57. Hampson DB, St Clair Gibson A, Lambert MI, Noakes TD. The
influence of sensory cues on the perception of exertion during exercise and
central regulation of exercise performance. Sports Med. 2001;31(13):935-52.
58. Rauch HG, St Clair Gibson A, Lambert EV, Noakes TD. A signalling
role for muscle glycogen in the regulation of pace during prolonged exercise.
Br J Sports Med. 2005 Jan;39(1):34-8.
59. Weltan SM, Bosch AN, Dennis SC, Noakes TD. Influence of muscle
glycogen content on metabolic regulation. Am J Physiol. 1998 Jan;274(1 Pt 1):E72-82.
Rev.int.med.cienc.act.fís.deporte - vol. 8 - número 32 - diciembre 2008 - ISSN: 1577-0354