Rev.int.med.cienc.act.fís.deporte- vol. 10 - número 37 - enero 2010 - ISSN: 1577-0354
Carrasco, L.; Sañudo, B.; Martínez,
I.C. y De Hoyo, M. (2010). Proteínas de estrés y ejercicio físico. Revista
Internacional de Medicina y Ciencias de
REVISIÓN
PROTEÍNAS DE ESTRÉS Y
EJERCICIO FÍSICO
HEAT
SHOCK PROTEINS AND EXERCISE
Carrasco, L.1;
Sañudo, B.2; Martínez, I.C3. y De Hoyo, M.4
Departamento de Educación Física y Deporte. Universidad
de Sevilla.
Recibido 13 de enero de 2009
Aceptado 22 de octubre de
2009
Código
UNESCO:
2411 – Fisiología humana.
Clasificación del Consejo de Europa: 6. Fisiología del ejercicio.
RESUMEN
Uno de mecanismos que
posee el organismo para contrarrestar la ruptura de la homeostasis es la
producción de proteínas de estrés o heat
shock proteins (HSP). Aumentos en la temperatura corporal, en la
concentración de Ca2+ y de ciertos corticoides así como disminuciones
del pH, de la glucemia y del glucógeno se presentan, junto a la isquemia, como
los principales agentes desencadenantes de la respuesta de HSP. La práctica de
ejercicio físico integra gran parte de estos factores, lo que provoca una clara
liberación de HSP muscular tras diferentes tipos de esfuerzos. Factores como la
edad, el género, el nivel de entrenamiento, la intensidad y el volumen del
ejercicio realizado o el tipo de fibra muscular, parecen tener una relación
directa con las adaptaciones biológicas relacionadas con las HSP. Son
necesarios más estudios para definir con mayor exactitud la función biológica
de las HSP vinculada con el ejercicio físico.
PALABRAS
CLAVE:
HSP, ejercicio físico, estrés, daño muscular.
ABSTRACT
One of mechanisms that organism use to counteract homeostasis rupture is
the release of heat shock proteins (HSP). Rises in body temperature, Ca2+
and corticoids concentrations as well as decreases in pH and glucose levels are
the main factors to produce HSP response. Physical activity practice integrates
most of these factors triggering an evident muscular HSP production after
different types of exercise. Factors such as age, gender, fitness level,
exercise intensity, exercise volume and muscle fiber type seem to maintain a
direct relationship with biological adaptations related to HSP. More studies
are needed to define exactly the biological function of HSP during exercise.
KEY WORDS: HSP,
exercise, stress, muscular damage.
INTRODUCCIÓN
Son diferentes los mecanismos que posee la
célula para contrarrestar los efectos de la ruptura de su homeostasis, como las
modificaciones temporales en la expresión genética y la alteración de su
estructura y funciones. En la actualidad existe un creciente interés en la
investigación de la respuesta celular a diferentes agentes estresores y, más en
concreto, en la producción de una serie de proteínas, las denominadas proteínas
de estrés o heat shock proteins (HSP).
Las HSP se han conservado adecuadamente a lo
largo de la evolución celular1. Están presentes en todos los
organismos, desde las bacterias hasta las células más complejas, presentando,
entre especies, una alta correspondencia en sus aminoacidos residuales, algo
que apunta hacia una función universal de las HSP en la respuesta celular al
estrés. Su descubrimiento en larvas de Drosophila melanogaster (mosca del
vinagre) se produjo a principios de la década de los años 60, tras someter a
estos insectos a cierto estrés térmico, de ahí su denominación2.
En su nomenclatura, las proteínas de estrés
se expresan en mayúsculas cuando se hace referencia a la familia proteica
completa (p.e.: HSP70), mientras que, cuando se nombra a una proteína en
concreto, la letra “H” se escribe en mayúsculas y las letras “s” y “p” se
escriben en minúsculas (p.e.: Hsp32). Esta aclaración es necesaria, ya que,
después de la revisión documental efectuada, se han encontrado numerosos
errores terminológicos y conceptuales al denominar las proteínas que han sido
objeto de estudio.
Por otro lado, su clasificación atiende a la
masa molecular. De esta forma, pueden diferenciarse diversas proteínas en un
rango de 8 a 110 kDa. En la Tabla 1 se
exponen las principales HSP con su localización celular y su función biológica
propuesta.
Tabla 1. Principales
HSP, localización celular y función biológica sugerida. Adaptada de Kregel3.
|
HSP |
Localización
celular |
Función
propuesta |
|
Alfa
B-cristalina |
Mitocondria |
Chaperón
molecular |
|
Hsp27
(sHsp) |
Citosol,
núcleo |
Estabilización
de microfilamentos, antiapoptótica. |
|
Hsp60 |
Mitocondria |
Reparación
de proteínas, prevención de la agregación de proteínas desnaturalizadas |
|
HSP70: |
|
Antiapoptótica |
|
Hsp70 - Hsp72 |
Citosol,
núcleo |
Reparación
de proteínas, protección celular |
|
Hsp73(Hsc70) |
Citosol,
núcleo |
Chaperón
molecular |
|
Hsp75(GRP75) |
Mitocondria |
Chaperón
molecular |
|
Hsp78(GRP78) |
RE |
Protección
celular, chaperón molecular |
|
HSP90 |
Citosol,
RE, núcleo |
Regulación
de los receptores de hormonas esteroideas, traslación proteica, reparación de
proteínas |
|
HSP 104-110 |
Citosol,
núcleo (110) |
Reparación
de proteínas |
HSP: proteínas de
estrés (familias);Hsp: proteínas de estrés (miembros); sHSP: small HSP; Hsc:
proteína de estrés cognada; GRP: proteína glucorreguladora; RE: retículo
endoplasmático.
En cuanto a su
estructura molecular, las HSP presenta tres partes bien diferenciadas: un
dominio N-terminal ATPasa (hoja beta), con gran nivel de conservación, un
dominio de ligandos peptídicos (hélice alfa) y la parte C-terminal, un dominio
ciertamente variable. Además, existe un lugar específico para la unión de
proteasas que une los dos primeros dominios de la molécula aquí descritos.
1.1. MECANISMOS DE ACCIÓN Y REGULACIÓN
La activación génica de las HSP ocurre como
consecuencia de diferentes factores, pudiendo éstos actuar de forma aislada o
simultánea. La depleción de energía, situaciones de hipoxia, acidosis o
isquemia, las especies reactivas del oxígeno (ROS) y del nitrógeno o bien una
infección viral, pueden inducir la transcripción de las HSP, como es el caso de
Hsp70.
El gen precursor de la Hsp70 está compuesto
por 2440 pares de bases, presentando una primera secuencia de 212 pares de
bases y una secuencia final de 242 pares de bases (o región 3’ no traducida)4. Además, hay, al menos, dos elementos
reguladores en la región 5’ que interactúan con unas determinadas proteínas:
los factores de transcripción de las HSP (HSFs 1, 2 y 4 en humanos)5.
La regulación de la respuesta o expresión de
las HSP consta de diferentes niveles, representando un sistema complejo6.
En primer lugar, los mismos estímulos que desencadenan la expresión de HSP
actúan, a la vez, como agentes reguladores de dicha respuesta. En este sentido,
se ha demostrado que la respuesta de Hsp70 inducida por diferentes agentes
estresores está relacionada con la intensidad o grado de estrés experimentado7.
Por otra parte, la respuesta de las HSP al
estrés parece tener un mecanismo de auto-regulación8. En ausencia de
estrés, la Hsp70 permanece unida al HSF; sin embargo, durante el episodio
estresante, la Hsp70 se disocia del HSF y, ya libre, captura las proteínas
desnaturalizadas, potenciando la formación de trímeros de HSF, que entran en el
núcleo de la célula y se unen a la región 5’ del gen que contiene el elemento promotor
(heat shock element o HSE), dando como resultado la producción de Hsp70. Esta
producción permite una nueva asociación HSP-HSF, evitando así la unión del HSF
en la región anteriormente descrita del gen precursor, controlando, por tanto,
la concentración intracelular de Hsp70 (Figura 1).
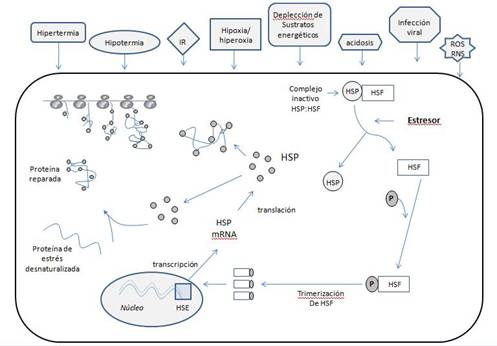
Figura 1. Mecanismos de acción y regulación de las HSP.
Adaptado de Kregel3.
IR: isquemia / reperfusión.
Al igual que otras muchas proteínas, las HSP poseen una regulación transcripcional. De este modo, y tal y como se ha comprobado en diferentes estudios, el estrés derivado del ejercicio físico induce un aumento en la concentración de Hsp70 mRNA9. En este sentido, se ha observado una notable diferencia en las concentraciones de Hsp70 mRNA y Hsp70 como resultado de la respuesta al estrés, lo que sugiere que dicha respuesta de Hsp70 puede estar regulada independientemente, bien a nivel proteico bien a nivel del mRNA6. En cualquier caso, todo parece indicar que las células que están regularmente expuestas a estrés (por ejemplo ejercicio a largo plazo) expresan niveles basales de HSP más bajos que células que están menos estresadas frecuentemente10.
1.2. FUNCIONES BÁSICAS
Una de las principales funciones de las
proteínas de estrés es luchar contra las
alteraciones y los defectos en la síntesis de otras proteínas celulares, con el
objeto de proteger a las células de los daños que puedan sufrir11.
Cualquier tipo de estrés, entendiendo por tal la alteración de la homeostasis,
es capaz de inducir su producción, pero en especial, factores como temperaturas
elevadas2, disminución del pH12, aumentos de la
concentración de Ca2+ 13 y de ciertos corticoides14,
isquemia, la disminución de la glucosa y el agotamiento del glucógeno15,
y otros factores, entre los que se encuentra el ejercicio16,17, son
causantes del aumento en los niveles de HSP.
De una forma más específica, las funciones
biológicas de las HSP se centran en dotar de protección a la célula frente al
estrés oxidativo18,19,20, atenuar el daño celular y facilitar su
regeneración actuando a modo de chaperones16,17,19,21,22,23,24,25, reducir
el efecto producido por la aterosclerosis26,27,28,29 y, según ha
llegado a establecerse, prevenir la apotosis30,31,32.
Además de
las funciones de protección intracelular indicadas, se ha planteado la
hipótesis que la Hsp70 y la Hsp72 cumplen funciones sistémicas. En concreto, se
ha postulado que la presencia extracelular de Hsp72 desempeña una serie de
funciones en la modulación del sistema inmunológico, pudiendo actuar a modo de
señal de alerta para dicho sistema durante los momentos de estrés33.
Por último, hay que destacar las funciones de
HSP70 en la célula muscular. En este sentido, son numerosas las investigaciones
que, hasta el momento, se han realizado con el fin de comprobar el grado de
implicación de estas proteínas en diferentes alteraciones o patologías así como
en distintos procesos biológicos que atañen al músculo esquelético. Los
resultados de dichos estudios vinculan la acción inflamatoria presente en el
síndrome de miopatía con agregados tubulares con la secreción de Hsp7034,35.
Además, se han encontrado bajas concentraciones intramusculares de Hsp70 mRNA y
Hsp72 en pacientes con diabetes tipo II36,37. En relación con la
distrofia muscular de Duchenne, se ha constatado la presencia de Hsp70 en las
fibras musculares afectadas, mientras que la expresión de Hsp70 se reduce al
hacerlo la severidad de los síntomas asociados38,39. El daño
muscular también implica una respuesta de Hsp70, cuya concentración intramuscular
aumenta al hacerlo la de creatina quinasa (CK)9. Por último,
diversos procesos biológicos, como la atrofia y la hipertrofia, conllevan la
participación activa de Hsp70 y Hsp72. En el primer caso, los niveles de Hsp70
se reducen durante el periodo de inactividad muscular40, mientras
que en el proceso hipertrófico se produce un aumento significativo de los
niveles de Hsp70 y Hsp72 que coincide con el aumento de IGF-140,41,42,43.
2.
RESPUESTAS DE HSP70 AL
EJERCICIO FÍSICO
El ejercicio, de forma similar a como lo
hacen otros agentes estresores, induce la expresión de HSP en diferentes células
y tejidos44. Puntschart et al.45 llevaron a cabo el
primer estudio en el que se analizó la respuesta de HSP al ejercicio físico. En
esta investigación, la concentración de Hsp70 mRNA aumentó significativamente a
los cuatro minutos de haber finalizado el esfuerzo (30 min de carrera sobre
tapiz a una intensidad correspondiente al umbral anaeróbico), alcanzando unos
niveles que se mantuvieron elevados hasta tres horas más. Otros estudios
posteriores han demostrado que la concentración de HSP70 aumenta tras la
realización tanto de ejercicios agudos como de larga duración18,46,47,48,49,50,51,52,
alcanzando unos niveles que se mantienen elevados a nivel intramuscular entre 6
y 7 días25.
Si bien el músculo esquelético ha centrado la
mayor parte del interés de los investigadores, existen estudios en los que se
ha certificado la respuesta de HSP70 en el entorno extracelular y en otro tipo
de células y tejidos. En este sentido, se ha encontrado un aumento en las
concentraciones plasmáticas de Hsp72 inmediatamente después del ejercicio53.
Asimismo, se han hallado aumentos de Hsp72 en monocitos inmediatamente después
de una carrera de 20 km54, lo que sugiere que este tipo de células
puede ser una fuente de liberación de Hsp72 hacia el plasma55,
aunque, para otros investigadores, tanto las causas de la respuesta como el punto
de origen de la secreción de HSP a la circulación quedan, todavía, por
identificar con exactitud10.
A continuación se analizan los factores que,
relacionados con el ejercicio físico, pueden ser los desencadenantes de la
respuesta de HSP70. Del mismo modo, se exponen las características del
ejercicio físico así como otros factores que pueden condicionar la respuesta de
HSP70, indicándose, para finalizar, las posibles funciones de estas proteínas
de estrés en su repuesta al ejercicio físico.
2.1. ESTÍMULOS DESENCADENANTES DE LA RESPUESTA DE HSP70
2.1.1. AUMENTO DE TEMPERATURA
La denominación de “heat shock proteins”
deriva de los primeros estudios en los que se consiguió aislar este tipo de
proteínas induciendo su respuesta a través del estrés térmico; de ahí su nombre
y la razón por la que se haya vinculado un aumento en su concentración con el
aumento de temperatura resultante del ejercicio físico.
Por un lado, estudios como los efectuados por
Morton et al.51, apuntan a una relación directa entre ejercicio,
aumento de la temperatura corporal y respuesta de HSP70. En su trabajo, estos
autores sometieron a un grupo de sujetos activos a una carrera de tipo
submáxima. Tras el esfuerzo, se observó
un aumento significativo (aunque variable) en los niveles
intramusculares de HSP70. La respuesta alcanzó sus máximos valores a las 48 h tras
el esfuerzo (aumento del 179 % respecto a la concentración pre-ejercicio),
manteniéndose elevada durante los 7 días post-ejercicio (178 % de la
concentración pre-ejercicio). De forma paralela, e inducida por el ejercicio,
se produjo un aumento significativo de la temperatura central, pasando de 37.5
± 0.2 ºC a 39.2 ± 0.3 ºC justo después
del esfuerzo. La temperatura muscular también mostró un aumento significativo
durante el ejercicio, pasando de 36.2 ± 0.7 ºC a 40 ± 0.3 ºC inmediatamente
después del ejercicio.
En esta misma línea, Ruell et al.1
analizaron la temperatura rectal y los niveles de Hsp72 en corredores que
habían sufrido un colapso a consecuencia del calor en una carrera de 14 km,
comparándolos con otros corredores que habían finalizado el esfuerzo sin ningún
tipo de problema. Además, el grupo de corredores perjudicados se dividió en
dos: aquéllos que presentaban síntomas serios y alteraciones neurológicas
(grupo CNS) y aquéllos que presentaban síntomas moderados (grupo MILD). Los sujetos del grupo CNS, con menos horas de
entrenamiento semanal, mostraron una mayor temperatura rectal que los
corredores del grupo control. Inmediatamente después del esfuerzo, los valores
de Hsp72 fueron muy superiores en los sujetos del grupo CNS en comparación con
los sujetos del grupo MILD y los corredores que no habían sufrido alteración
alguna (37.9, 20.9 y 17.0 ng/mL, respectivamente). Seis sujetos del grupo CNS mantuvieron
elevados sus niveles de Hsp72 nueve días después de la carrera. Además, existió
una correlación positiva entre los niveles de Hsp72 y la temperatura rectal registrada
inmediatamente después del esfuerzo (r = 0.597; p <0.001).
Por otra parte, se ha indicado que los aumentos de
temperatura corporal provocados por el ejercicio físico no son los causantes de
la respuesta de HSP7056. En este sentido, se han registrado
importantes respuestas de Hsp72 al ejercicio en un ambientes termo-neutrales, y
al realizar ejercicio físico sin aumentar la temperatura corporal10.
Además, se ha demostrado que, tras un
periodo de ejercicio con un incremento en la temperatura corporal hasta 40 ºC,
se produce una disminución en la concentración de HSP70 en leucocitos57.
2.1.2. ISQUEMIA
La isquemia relacionada con el ejercicio físico parece
tener cierta relevancia en dos tejidos: el músculo esquelético y el músculo
cardiaco. En este sentido, se ha llegado a determinar que, en el músculo
esquelético, elevados niveles de Hsp70 se asocian con la protección contra la lesión
hipóxica58. Sin embargo, es
el músculo cardiaco el
que ha focalizado la mayor parte de los estudios sobre las HSP.
Según Knowlton59 y Locke y Tanguay60,
el aumento de HSP producido por el ejercicio otorga defensa contra la isquemia -
reperfusión. Así, se ha indicado que realizar ejercicio físico entre 3 y 5 días
consecutivos mejora el rendimiento
contráctil del miocardio en el transcurso de la isquemia - reperfusión, una
protección miocárdica que se halla asociada al aumento de Hsp72 y antioxidantes
en el miocardio61. Es por ello que los ejercicios de resistencia aeróbica
son los que mejores efectos poseen sobre las lesiones cardiacas originadas por
el fenómeno isquemia-reperfusión62.
Aunque se desconoce exactamente la forma en que las HSP
producen los efectos beneficiosos sobre el corazón, se sospecha que su acción
protectora se efectúa sobre las mitocondrias, oponiéndose a la acción de los
radicales libres63 y sobre la apoptosis64.
2.1.3. METABOLISMO ENERGÉTICO.
Las demandas a las
que se ve sometido el metabolismo energético son otro tipo de estimulo para la
respuesta de Hsp706. De hecho, la depleción de glucógeno y ATP puede
inducir la respuesta de esta proteína de estrés7. Recientemente, se
ha observado que la ingesta de glucosa puede limitar el aumento en la
concentración sanguínea de Hsp72 producido como respuesta al ejercicio físico65.
Por otro lado, el aumento de la concentración de ácido láctico parece estar
relacionado con la respuesta de Hsp70, ya que, según los hallazgos conseguidos
por Pösö et al.66, el pico de ácido láctico obtenido tras un
esfuerzo intenso presentó una correlación significativa con la concentración
intramuscular de Hsp70 mRNA. En esta misma línea, el descenso en el pH
intracelular, experimentado como consecuencia de la realización de un ejercicio
de elevada intensidad, parece representar un estímulo potencial para la
respuesta de Hsp7012.
2.1.4. ESTRÉS OXIDATIVO
La familia HSP70 reacciona
rápidamente bajo condiciones de estrés oxidativo67,68, protegiendo a
la célula muscular de la acción de los radicales libres. Dado que el ejercicio
físico es un claro inductor de este tipo de estrés, se ha constatado su papel
en la respuesta de HSP706,69.
El músculo esquelético contiene un arsenal de sistemas
antioxidantes que parecen estar estrechamente relacionados con las HSP. Durante
el estrés, la activación del HSF-1 da lugar a un incremento de los niveles de
HSP mRNA y moléculas de HSP, haciendo a
las células más resistentes ante la aparición de futuros agentes nocivos. Esta
relación entre estrés oxidativo y HSP se ha constatado a través de la
administración de antioxidantes, ya que, tal y como se observó, consiguieron
bloquear la respuesta de HSP70 al estrés generado por un esfuerzo de tipo
aeróbico25.
En un interesante estudio, y tras comparar las concentraciones
plasmáticas de diferentes biomarcadores del estrés oxidativo y de Hsp70 en
jugadores profesionales de fútbol y en sujetos sedentarios, Banfi et al.70 observaron cómo los
niveles de las especies reactivas del oxígeno y el estado antioxidativo total
no mostraron diferencias significativas. Sin embargo, los deportistas
presentaron una mayor actividad de la enzima glutation reductasa así como
mayores niveles de óxido nítrico y de Hsp70, unos resultados que parecen
vincular la respuesta de Hsp70 con el estrés oxidativo.
2.2. INCIDENCIA DE LOS FACTORES GÉNERO Y EDAD
Uno de los efectos
del envejecimiento es la atrofia muscular. Tal y como se ha evidenciado, los
músculos esqueléticos envejecidos ven reducida su capacidad de adaptación tras
una actividad contráctil intensa71. La débil respuesta de Hsp70
observada en estos casos puede contribuir de manera importante en el desarrollo
de este déficit muscular asociado a la edad50. Además, y de forma
curiosa, la relación entre la edad y la respuesta atenuada de Hsp70 parece
específica según el tipo de fibra del que se trate, ya que se ha demostrado una
limitación en la expresión de Hsp70 en fibras rápidas de músculos esqueléticos
envejecidos en respuesta al ejercicio crónico72. Según Njemini et
al.73, la respuesta de Hsp72 en linfocitos y monocitos tras sufrir
estrés térmico decrece a medida que aumenta la edad de los sujetos, al igual
que ocurre en las células musculares. Sin embargo, en un reciente estudio, se
ha demostrado la existencia de diferencias en el contenido muscular de
HSP70 dependientes del factor edad, ya
que los músculos cuádriceps de ratones mayores presentan una mayor
concentración de esta proteína que los ratones adultos74.
En cualquier caso, se
ha establecido que la práctica regular de actividad física en la edad adulta
puede preservar la capacidad de respuesta de Hsp72 al estrés fisiológico75.
En cuanto al factor
género, es importante resaltar la ausencia de investigaciones en humanos, si
bien se han detectado algunas diferencias en animales de experimentación, ya
que Nickerson et al.76 encontraron una menor concentración de Hsp72
en ratas hembras localizada en la hipófisis, nódulos linfáticos mesentéricos e
hígado. Sin embargo, Voss et al.77 hallaron niveles cardiacos de
Hsp72 en ratas hembras dos veces superiores a los encontrados en los machos.
Estos autores vinculan esta diferencia con un mayor efecto protector de Hsp72
sobre el tejido cardiaco de las hembras.
2.3. NIVEL DE ENTRENAMIENTO Y RESPUESTAS DE HSP70.
Al igual que ocurre con otro tipo de adaptaciones,
los sujetos que se involucran en programas de ejercicio físico tienen mayores
posibilidades de incrementar sus niveles de HSP70 que sujetos pasivos cuando
quedan expuestos a estrés térmico10,78.
Sin embargo, no todos los resultados
coinciden con los anteriores. Morton et al.79 llevaron a cabo una
investigación en la que compararon las concentraciones de distintas HSP en
células musculares de sujetos entrenados y sedentarios. En situación basal, no
se dieron diferencias significativas en las concentraciones de HSP70, aunque
los sujetos entrenados presentaron unos niveles ligeramente superiores a los
encontrados en los sujetos sedentarios (16%). Tras realizar un ejercicio de
intensidad moderada (carrera de 45 min a una intensidad correspondiente al 75%
del VO2máx) no se observaron diferencias significativas en la
respuesta de HSP70 entre los sujetos entrenados y sedentarios, por lo que,
considerando tanto la situación basal como la respuesta al ejercicio, no
parecen existir adaptaciones de estas HSP debidas al entrenamiento.
Algunos autores, como es el caso de Fehrenbach
et al.54,80 y Gjovaag y Dahl78, han llegado a definir,
incluso, dos fases en la adaptación de las HSP relacionada con el entrenamiento
deportivo. En la primera de ellas, coincidiendo con las primeras etapas de este
proceso de entrenamiento, se puede observar un aumento de la respuesta de HSP70
al ejercicio físico; en la segunda fase, tras la realización de un considerable
volumen de entrenamiento, los sujetos experimentan un descenso en dicha
respuesta.
En cualquier caso, lo que sí parece existir
es un acuerdo sobre las adaptaciones producidas tras un periodo de
desentrenamiento. En este sentido, una semana de desentrenamiento es suficiente
para reducir de forma significativa la expresión de Hsp72 desarrollada durante un programa de
ejercicio físico de tres semanas de duración81.
2.4. EFECTOS DE LA INTENSIDAD Y VOLUMEN DEL EJERCICIO SOBRE LA
RESPUESTA DE HSP70
En términos generales, cualquier tipo de
ejercicio puede aumentar la expresión de las HSP en el músculo, ya sea bajo
activaciones musculares excéntricas o concéntricas82. Lo mismo
sucede con la forma en que se realiza,
es decir, tanto aguda42,49,83 como crónica46. Sin
embargo, dos de las principales características del ejercicio, frecuencia y
duración, pueden modular dicha respuesta, que también parece ser dependiente
del tejido orgánico objeto de análisis10.
En principio, parece existir una relación
directa entre la intensidad del ejercicio y la magnitud de la respuesta de
HSP7084. De hecho, varios estudios apoyan esta opinión, ya que sus
resultados mostraron un incremento en la respuesta de Hsp72 tras entrenamientos
de alta intensidad, algo que no ocurrió con entrenamientos en los que la
intensidad se redujo considerablemente81,85. Además, se ha llegado a
postular que la respuesta de HSP70 está relacionada con el aumento en la
concentración de ácido láctico resultante de la actividad muscular intensa66,85.
Sin embargo, y pese a lo indicado
anteriormente, se ha llegado a demostrar en humanos que el ejercicio prolongado
induce una mayor respuesta sérica de Hsp72 que ejercicios de corta duración,
aunque éstos últimos sean más intensos86. La persistencia de esta
discrepancia reside en la falta de estudios que comprueben el efecto de
diferentes intensidades y volúmenes de entrenamiento sobre la respuesta de
HSP70. Con este objetivo, Terje y Gjovaag87 diseñaron una
investigación en la que, tras aplicar entrenamientos con diferentes
intensidades y volúmenes, no encontraron ninguna diferencia al respecto,
denotando, por otra parte, una gran diferencia interindividual en lo que a la
respuesta de Hsp72 se refiere.
Considerando ambas posturas, es fácil
concluir que la respuesta de HSP al ejercicio depende tanto de la intensidad
como de la duración del mismo.
2.5. FUNCIONES DE HSP70 VINCULADAS CON EL EJERCICIO FÍSICO
2.5.1. PROTECCIÓN CELULAR Y FACILITACIÓN DE LA ADAPTACIÓN
MUSCULAR
De forma general, el
envejecimiento aumenta la susceptibilidad de las células de diferentes tejidos
orgánicos a morir por apoptosis. Las HSP (principalmente HSP70), bien de forma
aislada o combinada, ejercen una acción crucial en la supervivencia de los
miocitos, al prevenir la aparición de la apoptosis una vez que el corazón ha
sufrido los efectos de un proceso de isquemia/repercusión88,89.
Al igual que ocurre
con otros agentes generadores de estrés fisiológico, el ejercicio se presenta
como un factor protector frente al daño en el miocardio. Este efecto protector
parece basarse en diferentes cambios anatómicos de las arterias coronarias,
mejoras en la capacidad antioxidante del miocardio y en la inducción de HSP90.
En este sentido, se ha llegado a registrar una elevación en las concentraciones
de Hsp72 en el miocardio de más del 50%91,92, por lo que se está
valorando la prescripción de ejercicio físico por su capacidad de generar una
mayor resistencia al daño del miocardio93,94. Sin embargo, no se
sabe si los elevados niveles de Hsp72 son esenciales para alcanzar esa
protección contra la muerte celular, incluyendo la apoptosis. Tan sólo un
estudio reveló que no eran necesarios elevados niveles de Hsp72 para alcanzar
una protección contra la muerte celular tras el ejercicio92. De
hecho, se ha demostrado que 3-5 sesiones consecutivas de ejercicio conseguirían
el mismo nivel de protección del miocardio que semanas o meses de entrenamiento61.
Al igual que sucede
en el miocardio, las HSP parecen jugar un papel protector en el músculo
estriado, pudiendo facilitar su adaptación cuando su actividad se ve aumentada
a causa del ejercicio físico. De hecho, en las horas y días posteriores a un
esfuerzo intenso, se observa un incremento en la síntesis de HSP70,
probablemente para modular los procesos de recuperación y
remodelación/adaptación y proteger así a las fibras musculares que se ven
implicadas en dicho ejercicio25,95. En esta línea, se cree, de forma
hipotética, que como resultado de un programa de ejercicio físico las
concentraciones de HSP70 en los músculos se incrementarían protegiéndolos del
deterioro y de la pérdida de su funcionalidad relacionada con la edad74.
Además, parece ser que esta función protectora de HSP70 que
ha sido liberada como respuesta al ejercicio se lleva a cabo, preferentemente,
sobre los músculos que se hallan constituidos principalmente por fibras lentas,
en las que se expresan con gran abundancia la Hsp72 y la Hsp7396.
2.5.2. REGULACIÓN DEL METABOLISMO ENERGÉTICO
El metabolismo
energético es crucial para el funcionamiento celular, donde HSP70 actúa a modo
de pivote en el mantenimiento de la homeostasis y facilitando la adaptación
celular. La participación de HSP70 en la regulación del metabolismo energético
se centra en dos aspectos6. Por un lado, y como ya se ha indicado en
un apartado anterior, diferentes condiciones energéticas (depleción de
glucógeno y ATP; acumulación de ácido láctico y descenso del pH) provocan la
respuesta de HSP70. Por otra parte, HSP70 puede ejercer un efecto directo o
indirecto sobre el metabolismo energético. En el primer caso, y tal y como se
ha demostrado, Hsp70 contiene un fragmento de ATPasa, algo que puede modular la
concentración intracelular de ATP97.
En otro de los
estudios realizados, se demostró que un tratamiento hipertérmico previo en el
músculo incrementa significativamente la actividad oxidativa de enzimas
mitocondriales como el citocromo C, coincidiendo con un aumento paralelo en la
expresión de HSP7098.
Una investigación en
la que se utilizó una línea celular Hella transgénica con el fin de determinar
la incidencia de HSP70 sobre la concentración de ATP, se controló la expresión
de esta proteína de estrés, diferenciando células con baja, modera y elevada
expresión de HSP70 tomando como referencia los niveles fisiológicos. Los
resultados mostraron que, en comparación con las células no modificadas, las
mayores concentraciones de ATP fueron registradas en aquéllas en las que se
indujo una expresión de HSP70 de tipo moderada (similar a la que se produce
bajo estrés fisiológico), no en aquéllas en las que se indujo una elevada
expresión de esta proteína de estrés. En este estudio se analizó, además, el
efecto ejercido por la expresión de HSP70 sobre el metabolismo glucídico y
oxidativo. Los datos obtenidos, relacionados con las células en las que se
indujo una sobreexpresión de Hsp70, muestran un aumento en la tasa de consumo
de glucosa y de producción de ácido láctico, mientras que, a excepción de un
aumento en la actividad de la citrato sintetasa, no se registraron diferencias
significativas en el metabolismo oxidativo con las células no modificadas y
utilizadas como control99. Además, para estos autores, el papel de HSP70
en la preservación de la concentración intracelular de ATP está vinculado a su
efecto estimulante sobre la glucólisis.
En cuanto al efecto
indirecto de la HSP70 sobre el metabolismo energético, se ha especulado que su
influencia sobre la glucólisis puede estar asociada con el transporte de
glucosa. De hecho, se ha descubierto, por un lado, que en células musculares de
pacientes diabéticos tipo II, los niveles de HSP70 se vieron significativamente
reducidos37, y por otro, que la baja expresión de HSP70 correlaciona
con la resistencia a la insulina36.
Por último, otra
posible participación de HSP70 en el metabolismo energético tiene que ver con
la modulación de la calmodulina, una proteína reguladora del calcio que
interactúa con la hexoquinasa, la única enzima glucolítica que, ligada a la
mitocondria, juega un importante papel en intercambio de hidrógeno100.
También se ha indicado que el efecto de HSP70 sobre la glucólisis se basa en la
prevención de la inhibición de la enzima lactato deshidrogenasa, una inhibición
causada, principalmente, por el estrés celular101.
2.5.3. RELACIÓN CON LA RESPUESTA DEL SISTEMA INMUNOLÓGICO
Tal y como se ha indicado en el apartado introductorio, una
de las funciones que se ha venido asignando a las HSP desde los primeros estudios
efectuados en humanos es la de estimular la respuesta del sistema inmunológico
ante el estrés sufrido por diferentes tejidos orgánicos. De hecho, se ha
hipotetizado que las proteínas de choque
térmico actúan como señales de alerta o de "peligro" para el sistema
inmunológico durante los momentos de estrés33, activándose la liberación de
ciertas citoquinas y provocando los correspondientes procesos inflamatorios1.
Cuando la estructura de la célula muscular queda alterada
como consecuencia del estrés derivado del ejercicio físico intenso, el conjunto
de HSP70 y exosomas salen al espacio extracelular, lo que, unido al daño
producido en la membrana, desata la respuesta inmunológica proinflamatoria en
el tejido muscular ejercitado25.
Se ha constatado que la elevación de los
niveles extracelulares de Hsp72 produce la respuesta de citoquinas proinflamatorias (TNF,
IL-1, IL-6 y IL-8), la activación de la cascada del complemento y de CD40+, llegando
a constituir, además, células antígenas102,103,104. Otros estudios,
realizados en base a esfuerzos intensos, como una carrera a pie de más de una
hora de duración, han mostrado aumentos de los niveles de HSP70 citoplasmáticos
en leucocitos, lo que no hace sino remarcar la relación entre estas proteínas
de estrés y el sistema inmunológico.
3.
CONCLUSIONES Y
PERSPECTIVAS DE INVESTIGACIÓN
Entre los diversos
mecanismos que posee el organismo para contrarrestar la ruptura de la
homeostasis, uno de los más importantes es la producción de HSP. Una gran
variedad de agentes estresores puede inducir dicha producción, si bien el
incremento de la temperatura corporal, la disminución del pH, los aumentos en
la concentración de Ca2+, la liberación de glucocorticoides,
diferentes procesos de isquemia, la disminución de los niveles de glucosa y el
agotamiento del glucógeno se muestran como factores inductores clave.
La práctica de
ejercicio físico implica la intervención de gran parte de los agentes
estresores anteriormente mencionados, por lo que se ha venido utilizado como
medio para el estudio de las respuestas y adaptaciones de HSP. Esfuerzos de
diferente naturaleza potencian la respuesta de HSP70, siendo su intensidad uno
de los parámetros decisivos en la magnitud de dicha respuesta. En este sentido,
no parece que el volumen o duración del ejercicio sea tan determinante como la
intensidad del mismo, existiendo opiniones contrarias al respecto. Otros
factores, como la edad, el género y el nivel de entrenamiento pueden
condicionar las respuestas y adaptaciones de HSP70 al ejercicio; sin embargo,
es necesario el planteamiento de nuevos experimentos que clarifiquen el grado
de incidencia de dichos factores.
Para finalizar, y de
cara a afrontar nuevos estudios que permitan comprender aún más el papel de HSP70
en respuesta el ejercicio físico, sería interesante definir con exactitud la
cinética de la producción de estas HSP durante el esfuerzo (y no sólo a su
finalización), así como evaluar los efectos de la inoculación de estas
proteínas sobre la recuperación de deportistas. Por otro lado, la respuesta de
HSP al estrés de origen psicológico, así como su implicación en enfermedades
caracterizadas por el dolor crónico, suponen nuevas perspectivas de
investigación.
4.
REFERENCIAS
1. Ruell PA, Thompson MW, HoVman KM, Brotherhood
JR, Richards DAB. Plasma Hsp72 is higher in runners with more serious symptoms
of exertional heat illness. Eur J
Appl Physiol, 2006; 97: 732–736.
2. Ritossa F. Discovery of the heat shock
response. Cell Stress Chaperones, 1996;
1: 97–98.
3. Kregel KG. Heat shock proteins: modifying factors in
physiological stress responses and acquired thermotolerance. J Appl Physiol, 2002; 92: 2177-2186.
4. Wu BJ, Kingston RE, Morimoto RI. Human HSP70 promoter contains at least
two distinct regulatory domains. Proc
Natl Acad Sci U S A, 1986; 83: 629–633.
5. Pirkkala L, Nykänen P, Sistonen L. Roles of the heat shock transcription factors
in regulation of the heat shock response and beyond. FASEB J, 2001;
15: 1118-1131.
6. Liu Y, Gampert L, Nething K, Steinacker JM. Response and function of
skeletal muscle heat shock protein 70. Front Biosci, 2006; 11: 2802-2827.
7. Liu Y, Steinacker JM. Changes in skeletal muscle heat shock proteins:
pathological significance. Front Biosci, 2001;
6: D12-D15.
8. DiDomenico BJ, Bugalsky GE, Lindquist S. The heat shock response is
self-regulated at both the transcriptional and posttranscriptional levels. Cell,
1982; 31 (part 2): 593-603.
9. Liu Y, Mayr S, Opitz-Gress A, Zeller C, Lormes W, Baur S, et al. Human
skeletal muscle HSP70 response to training in highly trained rowers. J Appl
Physiol, 1999; 86: 101-104.
10. Whitham M, Laing S, Jackson A, Maassen N, Walsh N. Effect of exercise
with and without a thermal clamp on the plasma heat shock protein 72 response. J
Appl Physiol, 2007; 103: 1251-1256.
11. Powers SK, Locke M, Demirel HA. Exercise, heat shock proteins, and
myocardial protection from I-R injury. Med Sci Sports Exerc, 2001; 33: 386-392.
12. Whelan SA, Hightower LE. Differential induction of glucose-regulated and
heat shock proteins: effects of pH and shulfhydryl-reducing agents ion chicken
embryo cells. J Cell Physiol, 1985; 125: 251-258.
13. Ding XZ, Smallridge
RC, Galloway RJ, Kiang JG. Increases in HSF1 translocation and synthesis in
human epidermoid A-431 cells: role of protein kinase C and [Ca2]. J Investig
Med, 1996; 44: 144–153.
14. Sun L, Chang J,
Kirchhoff SR, Knowlton AA. Activation of HSF and selective increase in
heat-shock proteins by acute dexamethasone treatment. Am J Physiol Heart Circ
Physiol, 2000; 278: H1091–H1097.
15. Febbraio MA, Steensberg A, Walsh R, Koukoulas
I, van Hall G, Saltin B, et al. Pedersen BK. Reduced glycogen availability is
associated with an elevation in HSP72 in contracting human skeletal muscle. J Physiol, 2002; 538: 911–917.
16. Maglara AA, Vasilaki A, Jackson MJ, McArdle A.
Damage to developing mouse skeletal muscle myotubes in
culture: protective role of heat shock proteins. J Physiol, 2003; 548: 837–846.
17. McArdle F, Spiers
S, Aldemir H, Vasilaki A, Beaver A, Iwanejko I, et al. Preconditioning of
skeletal muscle against contraction-induced damage: the role of adaptations to
oxidants in mice. J Physiol, 2004; 561: 233–244.
18. Smolka MB, Zoppi CC,
Alves AA, Silveira LR, Marangoni S, Pereira-Da-Silva L, et al. HSP72 as a complementary protection against oxidative stress induced
by.exercise in the soleus muscle of rats. Am J Physiol Regul Integr Comp
Physiol, 2000; 279: R1539-R1545.
19. Selsby JT, Dodd SL. Heat treatment reduces oxidative stress and protects muscle mass
during immobilization. Am J Physiol Regul Integr Comp Physiol, 2005; 289:
R134-R139.
20. Selsby JT, Rother S, Tsuda S, Pracash O, Quindry J, Dodd SL. Intermittent hyperthermia enhances skeletal muscle regrowth and attenuates
oxidative damage following reloading. J Appl Physiol, 2007; 102: 1702-1707.
21. Naito H, Powers SK, Demirel HA, Sugiura T, Dodd SL, Aoki J. Heat stress
attenuates skeletal muscle atrophy in hindlimb-unweighted rats. J Appl Physiol, 2000; 88: 359-363.
22. Mayer MP, Bukau B. Hsp chaperones:
cellular functions and molecular mechanism. Cell Mol Life Sci, 2005; 62: 670-684.
23. Miyabara
EH,
Martin
JL,
Griffin
TM,
Moriscot
AS,
Mestril
R.
Overexpression of inducible 70-kDa heat shock protein
in mouse attenuates skeletal muscle damage induced by cryolesioning. Am J
Physiol Cell Physiol, 2006; 290: C1128-C1138.
24. Whitham M, Fortes MB. Effect of blood handling on extracellular Hsp72
concentration after high-intensity exercise in humans. Cell Stress Chaperones,
2006; 11: 304-308.
25. Paulsen G, Vissing K, Kalhovde JM, Ugelstad I, Bayer ML, Kadi F, et al.
Maximal eccentric exercise induces a rapid accumulation of small heat shock
proteins on myofibrils and a delayed HSP70 response in humans. Am J Physiol
Regulatory Integrative Comp Physiol, 2007; 293: 844-853.
26. Xu Q. Role of heat shock proteins in atherosclerosis. Arterioscler
Thromb Vasc Biol 2002; 22: 1547-1559.
27. Martin-Ventura JL, Duran MC, Blanco-Colio LM, Meilhac O, Leclercq A, Michel JB, et al. Identification by a differential proteomic approach of heat shock
protein 27 as a potential marker of atherosclerosis. Circulation, 2004; 110:
2216-2219.
28. Mehta
TA,
Greenman
J,
Ettelaie
C,
Venkatasubramaniam
A,
Chetter
IC,
McCollum
PT.
Heat shock proteins in vascular disease--a review. Eur
J Vasc Endovasc Surg, 2005; 29:
395-402.
29. Park HK, Park EC, Bae SW, Park MY, Kim SW, Yoo HS, et al. Expression of heat shock protein 27 in human atherosclerotic plaques
and increased plasma level of heat shock protein 27 in patients with acute
coronary syndrome. Circulation, 2006;
114: 886-893.
30. Beere HM, Wolf BB, Cain K, Mosser DD, Mahboubi A, Kuwana T, et al. Heat-shock
protein 70 inhibits apoptosis by preventing recruitment of procaspase-9 to the
Apaf-1 apoptosome. Nat Cell Biol, 2000;
2: 469-475.
31. Garrido C, Gurbuxani S, Ravagnan L, Kroemer G. Heat shock proteins: endogenous modulators of apoptotic cell death. Biochem
Biophys Res Commun, 2001; 286: 433-442.
32. Siu P, Bryner RW, Martyn JK, Always SE. Apoptotic adaptations from
exercise training in skeletal and cardiac muscles. FASEB J, 2004; 18: 1150-1152.
33. Matzinger P. An
innate sense of danger. Semin Immunol, 1998; 10: 399–415.
34. Schett G, Redlich K, Xu P, Bizan P, Gröger M, Tohidast-Akrad M, et al. Enhanced expression of heat shock protein 70
(hsp70) and heat shock factor 1 (HSF1) activation in rheumatoid arthritis
synovial tissue. J Clin Invest, 1998;
102: 302-311.
35. Febbraio MA, Steensberg A, Fischer CP, Keller C, Hiscock N, Pedersen BK.
IL-6 activates Hsp72 gene expression in human skeletal muscle. Biochem Biophys
Res Commun, 2002; 296: 1264-1266.
36. Kurucz I, Morva A, Vaag A, Eriksson KF, Huang X, Groop L, et al.
Decreased expression of heat shock protein 72 in skeletal muscle of patients
with type 2 diabetes correlates with insulin resistance. Diabetes, 2002; 51:
1102-1109.
37.
Bruce
CR, Carey AL, Hawley JA, Febbraio MA. Intramuscular
heat shock protein 72 and heme oxigenase-1 mRNA are reduced in patients with
type 2 diabetes: evidence that insulin resistance is associated with a
disturbed antioxidant defense mechanism. Diabetes, 2003; 52: 2338-2345.
38.
Bornman L, Polla BS,
Lotz BP, Gericke GS. Expression of heat shock/stress proteins in Duchenne
muscular dystrophy. Muscle & Nerve, 1995; 18: 23-31.
39.
Ardle
AM, Jackson MJ. Heat shock protein 70 expression in skeletal muscle. Biochem
Soc Trans, 1996; 24: 485S.
40. Oishi Y, Taniguchi K, Matsumoto H, Kawano F, Ishihara A, Ohira Y.
Upregulation of HSP72 in reloading rat soleus muscle after prolonged hindlimb
unloading. Jpn J Physiol, 2003; 53: 281-286.
41. Hameed M, Orrell RW, Cobbold M, Goldspink G, Harridge SDR. Expression of
IGF-1 splice variants in young and old human skeletal muscle after high
resistance exercise. J Physiol, 2003; 547: 247-254.
42. Thompson HS, Maynard EB, Morales ER, Scordilis SP. Exercise-induced
HSP27, HSP70 and MAPK responses in human skeletal muscle. Acta Physiol Scand,
2003; 178: 61-72.
43. Desplanches D, Ecochard L, Sempore B, Mayet-Sornay MH, Favier R.
Sekeletal muscle HSP72 response to mechanical unloading: influence of endurance
training. Acta Physiol Scand, 2004;
180: 387-394.
44. Fehrenbach E, Niess AM. Role of heat shock proteins in the exercise
response. Exerc Immunol Rev, 1999; 5: 57-77.
45. Puntschart AM, Vogt HR, Widmer H, Hoppeler H, Billeter R. Hsp70
expression in human skeletal muscle after exercise. Acta Physiol Scand, 1996;
157: 411-417.
46. González B, Hernando R, Manso R. Anabolic steroid and gender-dependent modulation of cytosolic HSP70s in
fast- and slow-twitch skeletal muscle. J Steroid Biochem Mol Biol, 2000; 74: 63-71.
47. McArdle A, Pattwell D, Vasilaki A, Griffiths RD, Jackson MJ. Contractile
activity-induced oxidative stress: cellular origin and adaptative responses. Am
J Physiol Cell Physiol, 2001; 280: C621-C627.
48. Thompson HS, Scordilis SP, Clarkson PM, Lohrer WA. A single bout of
eccentric exercise increases HSP27 and HSC/HSP70 in human skeletal muscle. Acta
Physiol Scand, 2001; 171: 187-193.
49. Khassaf M, Child RB, McArdle A, Brodie DA,
Esanu C, Jackson MJ. Time course of responses of human skeletal muscle to
oxidative stress induced by nondamaging exercise. J Appl Physiol, 2001; 90: 1031–1035.
50. Vasilaki A, Jackson MJ, McArdle A. Attenuated HSP response in skeletal
muscle of aged rats following contractile activity. Muscle & Nerve, 2002;
25: 902-905.
51. Morton JP, MacLaren DP, Cable NT, Bongers T, Griffiths RD, Campbell IT,
et al. Time course and differential responses of the major heat shock protein
families in human skeletal muscle following acute nondamaging treadmill exercise.
J Appl Physiol, 2006; 101: 176-182.
52. Vasilaki A, McArdle F, Iwanejko LM, McArdle A. Adaptative responses of
mouse skeletal muscle to contractile activity: the effect of age. Mech Ageing
Dev, 2006; 127: 830-839.
53. Walsh RC, Koukoulas I, Garnham A, Moseley PL,
Hargreaves M, Febbraio MA. Exercise increases serum Hsp72 in humans. Cell
Stress Chaperones, 2001; 6: 386–393.
54. Fehrenbach E, Passek F, Niess AM, Pohla H,
Weinstock C, Dickhuth HH, et al. HSP expression in human leukocytes is
modulated by endurance exercise. Med Sci Sports Exerc, 2000; 32: 592–600.
55. Hunter-Lavin C, Davies EL, Bacelar MFVG,
Marshall MJ, Andrew SM, Williams JHH. Hsp70 release from peripheral blood
mononuclear cells. Biochem Biophys Res Commun, 2004; 324: 511–517.
56. Morton JP, MacLaren DP, Cable T, McArdle A, Drust B. Time –course and
differential expression of heat shock proteins in human skeletal muscle
following non-damaging treadmill exercise: Is heat a mechanism of activation?
Procedings of 11th Annual Congress of the European College of Sports Science;
2006. p. 211.
57. Ryan AJ, Gisolfi CV, Moseley PL. Synthesis of
70K stress protein by human leukocytes: effect of exercise in the heat. J Appl
Physiol, 1991; 70: 466-471.
58. Voss MR, Gupta S, Stice JP, Baumgarten G, Lu
L, Tristan JM, et al. Effect of mutation of amino acids 246–251 (KRKHKK) in
HSP72 on protein synthesis and recovery from hypoxic injury. Am J Physiol Heart Circ Physiol, 2005; 289: H2519–H2525.
59. Knowlton A. An overview of the heat shock
proteins, their regulation, and function. In Knowlton A, editor. Heat Shock
Proteins and the Cardiovascular System. Boston: Kluwer Academic Publishers;
1997. p. 1-24.
60. Locke M, Tanguay RM. Diminished heat shoch response of the aged
myocardium. Cell Stress Chaperones, 1996; 1: 189-196.
61. Demirel HA, Powers SK,
Zergeroglu MA, Shanely
RA,
Hamilton
K,
Coombes
J,
et al. Short-term exercise
improves myocardial tolerance to in vivo ischemia-reperfusion in the rat. J
Appl Physiol, 2001;
91:
2205-2212.
62. Taylor RP, Harris M, Starnes J. Acute exercise can improve cardio
protection without increasing heat shock protein content. Am J Physiol, 1999;
276: H1098-H1102.
63. Polla B, Kantengwa S, Francois D,
Salvioli S, Franceschi C, Marsac C, et al. Mitochondria are selective targets for the protective effects of heat
shock against oxidative injury. Proc Natl Acad Sci USA, 1996; 93: 6458-6463.
64. Moser D, Caron A, Bourget L, Denis-Larose C. Role of the human heat
shock protein HSP70 in protection against stress-induced apoptosis. Mol Cell
Biol, 1997; 17: 5317-5327.
65. Febbraio MA, Mesa JL, Chung J, Steenberg A. Glucose ingestion attenuates
the exercise-induced increase in circulating heat shock protein 72 and heat
shock protein 60 in humans. Cell Stress Chaperones, 2004; 9: 390-396.
66. Pösö AR, Eklund-Uusitalo S, Hyyppa S, Pirila E. Induction of heat shock protein 72 mRNA in skeletal muscle by exercise
and training. Equine Vet J, 2002; Suppl 214-218.
67. Welch WJ. Mammalian stress response: cell
physiology, structure/function of stress proteins, and implications for
medicine and disease. Physiol Rev, 1992; 72: 1063–1081.
68. Kampinga HH. Thermotolerance in mammalian
cells: protein denaturation and aggregation and stress proteins. J Cell Sci, 1993; 104: 11–17.
69. Fischer CP, Hiscock NJ, Basu S, Vessby B,
Kallner A, Sjogaard LB, et al. Vitamin E isoform-specific inhibition of the
exercise-induced heat shock protein 72 expression in humans. J Appl Physiol, 2006; 100: 1679–1687.
70. Banfi G, Malavazos A,
Iorio E, Dolci A, Doneda L, Verna R, et al. Plasma oxidative stress biomarkers, nitric oxide and heat shock protein
71. Vasilaki, A, Iwanejko LM, McArdle F, Broome CS, Jackson MJ, McArdle A.
Skeletal muscles of aged male mice fail to adapt to contractile activity. Biochem
Soc Trans, 2003; 31: 455-456.
72. Naito H, Powers SK, Demirel HA, Aoki J. Exercise training increase heat
shock protein in skeletal muscles of old rats. Med Sci Sports Exerc, 2001; 33:
729-734.
73. Njemini R, Lambert M, Demanet C, Vanden Abeele M, Vandebosch S, Mets T.
The induction of heat shock protein 70 in peripheral mononuclear blood cells in
elderly patients: a role for inflammatory markers. Hum Immunol, 2003; 64: 575–585.
74. Kayani AC, Close GL, Jackson MJ, McArdle A. Prolonged treadmill training
increases HSP70 in skeletal muscle but does not affect age-related functional
deficits. Am J Physiol Regul Integr Comp Physiol, 2008; 294: R568-R576.
75. Simar D, Malesta D, Koechlin C, Cristol JP, Vendrell JP, Caillaud C.
Effect of age on Hsp72 expression in leukocytes of healthy active people. Exp
Gerontol, 2004; 39: 1467-1474.
76. Nickerson M, Kennedy SL, Johnson SD, Fleshner M. Sexual dimorphism of
the intracellular heat shock protein 72 response. J Appl Physiol, 2006; 101:
566-575.
77. Voss MR, Stallone JM, Li M, Cornelussen RN, Knuefermann P, Knowlton AA.
Gender differences in the expression of heat shock proteins: the effect of
estrogen. Am J Physiol Heart Circ Physiol,
2003; 285: H687-H692.
78. Gjovaag TF, Dahl HA. Effect of training and detraining on the expression
of heat shock proteins in m.triceps brachii of untrained males and females. Eur J Appl Physiol, 2006; 98: 310-322.
79. Morton JP, MacLaren DP, Cable T, Campbell IT, Evans L, Kayani AC, et al.
Trained men display increased basal heat
shock protein content of skeletal muscle. Med Sci Sports Exerc, 2008; 40: 1255-1262.
80. Fehrenbach E, Niess AM, Scholtz E, Passek F,
Dickhut HH, Northhoff H. Transcriptional and translational regulation of heat
shock proteins in leukocytes of endurance runners. J App Physiol, 2000; 89: 704-710.
81. Liu Y, Lormes W, Wang L, Reissnecker S, Steinacker JM. Different
skeletal muscle hsp70 responses to high-intensity strength training and
low-intensity endurance training. Eur J Appl Physiol, 2004; 91: 330–335.
82. Febbraio MA, Koukoulas I. HSP72 gene expresión progressively increase in
human skeletal muscle during prolonged, exhaustive exercise. J Appl Physiol,
2000; 89: 1055-1060.
83. Shastry S, Toft DO, Joyner MJ. Hsp 70 and hsp 90 expression in
leukocytes after exercise in moderately trained humans. Acta Physiol Scand,
2002; 175: 139-146.
84. Milne KJ, Noble EG. Exercise-induced elevation of
HSP70 is intensity dependent. J Appl Physiol, 2002; 93: 561-568.
85. Vogt M, Puntchardt A, Geiser J, Zuleger C, Billeter R, Hoppeler H.
Molecular adaptations in human skeletal muscle to endurance training under
stimulated hypoxic conditions. J Appl Physiol, 2001; 91: 173-182.
86. Fehrenbach E, Niess AM, Voelker K, Northoff H, Mooren FC. Exercise intensity and duration affect blood
soluble HSP72. Int J Sports Med, 2005; 26: 552-557.
87. Terje F, Gjovaag HAD. Effect of training and detraining on the
expression of heat shock proteins in m.triceps brachii of untrained males and
females. Eur J Appl Physiol, 2006; 98: 310-322.
88. Lin KM, Lin B, Lian
IY, Mestril
R,
Scheffler
IE,
Dillmann
WH. Combined and
individual mitochondrial HSP60 and HSP10 expression in cardiac myocytes
protects mitochondrial function and prevents apoptotic cell deaths induced by
simulated ischemia-reoxygenation. Circulation, 2001; 103: 1787-1792.
89. Marini M, Lapalombella R, Margonato V, Ronchi R, Samaja M, Scapin C, et al. Mild exercise training, cardioprotection and
stress genes profile. Eur J Appl Physiol, 2007; 99: 503-510.
90. Powers SK, Demirel HA, Vincent HK, Coombes JS, Naito H, Hamilton KL, et
al. Exercise training improves myocardial tolerance to in vivo
ischemia-reperfusion in the rat. Am J Physiol, 1998; 275: R1468-R1477.
91. Harris MB, Starnes JW. Effects of body temperature
during exercise training on myocardial adaptations. Am J Physiol Heart Circ Physiol, 2001; 280: H2271-H2280.
92. Quindry JC, Hamilton KL, French JP, Lee Y, Murlasits Z, Tumer N, et al. Exercise-induced HSP-72
elevation and cardioprotection against infarct and apoptosis. J
Appl Physiol, 2007; 103: 1056-1062.
93. Hamilton KL, Staib JL, Phillips T, Hess A, Lennon SL, Powers SK. Exercise, antioxidants, and
HSP72: protection against myocardial ischemia/reperfusion. Free Radic Biol Med 2003; 34: 800-809.
94. Quindry J, French J, Hamilton K, Lee Y, Mehta JL, Powers S. Exercise training provides
cardioprotection against ischemia-reperfusion induced apoptosis in young and
old animals. Exp Gerontol, 2005; 40: 416-425.
95. Mattson JP, Ross
CR, Kilgore JL, Musch TI. Induction of mitochondrial stress proteins following
treadmill running. Med Sci Sports Exerc, 2000; 32: 365-369.
96. Locke M, Tanguay RM. Increased HSF activation in muscles with a high
constitutiveHSP70 expression. Cell Stress Chaperones, 1996; 1: 189-196.
97. Flaherty KM, McKay DB, Kabsch W, Holmes KC. Similarity of the three-dimensional
structures of actin and the ATPase fragment of a 70-kDa heat shock cognate
protein. Proc Natl Acad Sci USA, 1991; 88: 5041-5045.
98.
Chen HW, Chen SC,
Tsai JL, Yang RC. Previous hyperthermic treatment increases mitochondria
oxidative enzyme activity and exercise capacity in rats. Kaoshiung J Med Sci,
1999; 15: 572-580.
99. Steinacker JM, Wang J, Gampert L, Liu Y, Nething K, Prokopchuk O.
Effects of overexpression of heat shock protein 70 on energy metabolism. Med
Sci Sport Exerc, 2005; 37: S455.
100. Ehrhardt MR, Urbauer JL, Wand AJ. The energetics and dynamics of
molecular recognition by calmodulin. Biochemistry, 1995; 34: 2731-2738.
101. Zietara MS, Skorkowski EF. Thermostability of lactate deshydrogenase
LDH-A4 isoenzyme: effect of heat shock protein DnaK on the enzyme activity. Int
J Biochem Cell Biol, 1995; 27: 1169-1174.
102. Asea A, Kraeft SK,
Kurt-Jones EA, Stevenson MA, Chen LB, Finberg RW, et al. HSP70 stimulates
cytokine production through a CD14-dependant pathway, demonstrating its dual
role as a chaperone and cytokine. Nat Med, 2000;6: 435–442.
103. Prohaszka Z, Singh
M, Nagy K, Kiss E, Lakos G, Duba J, et al. Heat shock protein 70 is a potent
activator of the human complement system. Cell Stress Chaperones, 2002; 7:
17–22.
104. Wang Y, Whittall T,
McGowan E, Younson J, Kelly C, Bergmeier LA, et al. Identification of
stimulating and inhibitory epitopes within the heat shock protein 70 molecule
that modulate cytokine production and maturation of dendritic cells. J Immunol,
2005; 174: 3306–3316.
Rev.int.med.cienc.act.fís.deporte- vol. 10 - número 37 - enero 2010 - ISSN: 1577-0354