Rev.int.med.cienc.act.fís.deporte-
vol. 11 - número 41 - marzo 2011 - ISSN:
1577-0354
Peinado,
A.B., Díaz, V.; Benito, P.J.; Álvarez, M. y Calderón, F.J.
(2011). Simplificación de la ecuación de Stewart para
valorar el estado ácido-base. Revista
Internacional de Medicina y Ciencias de la Actividad Física y el Deporte vol.
10 (41) pp. 115-126. Http://cdeporte.rediris.es/revista/revista41/artecuacion197.htm
ORIGINAL
ECUACIÓN SIMPLIFICADA DE STEWART
PARA VALORAR EL ESTADO ÁCIDO-BASE EN EJERCICIO
A SIMPLIFICATION OF THE STEWART EQUATION TO DETERMINE
ACID-BASE STATUS IN EXERCISE
Peinado, A.B.1, Díaz, V.2; Benito,
P.J.3; Álvarez, M.4 y Calderón, F.J.5
1Doctora en Ciencias de la Actividad
Física y del Deporte. Profesora
Ayudante Doctor, Facultad de Ciencias de la Actividad
Física y del Deporte – INEF. Universidad Politécnica de Madrid, España (anabelen.peinado@upm.es).
2Doctor en Ciencias de la Actividad Física y del Deporte. Investigador postdoctoral, Facultad de Ciencias de la Actividad Física y del Deporte
– INEF. Universidad Politécnica de Madrid, España (victor.diaz@upm.es). Instituto de
Fisiología Veterinaria y Zurich Center for Integrative Human Physiology (ZIHP),
Universidad de Zurich, Suiza.
3Doctor en Ciencias de la
Actividad Física y del Deporte. Profesor Titular Interino, Facultad de Ciencias
de la Actividad Física y del Deporte – INEF. Universidad Politécnica de Madrid,
España (pedroj.benito@upm.es).
4Licenciada en Ciencias de la Actividad Física y del Deporte. Instituto de Fisiología Veterinaria y Zurich Center for Integrative Human Physiology (ZIHP), Universidad de Zurich,
Suiza. (mariaalvarezsanchez@gmail.com).
5Doctor en Medicina y
Cirugía. Profesor Titular de Universidad, Facultad de Ciencias de la Actividad
Física y del Deporte – INEF. Universidad Politécnica de Madrid, España (franciscojavier.calderon@upm.es).
Código UNESCO: 2411
Fisiología Humana
Clasificación del Consejo de Europa: 13.
Fisiología del deporte
Recibido 9 de
septiembre de 2009
Aceptado 3 de
noviembre de 2009
RESUMEN
El objetivo del estudio fue
simplificar la ecuación de Stewart y verificar la validez de la ecuación
propuesta. Veinticuatro varones realizaron un test a carga constante de 30
minutos en tapiz rodante. Fueron tomadas muestras de sangre capilar en reposo y
en los minutos 10, 20 y 30 del test. Los parámetros ácido-base fueron
analizados con un analizador de gases en sangre y el lactato por método
enzimático. La [H+] fue calculada usando la ecuación de Stewart y la
ecuación propuesta. La diferencia de medias entre la ecuación propuesta y la de Stewart fue de 0,004 nmol.L-1 para la [H+].
Sin embargo, la diferencia de medias entre las ecuaciones y los valores medidos
fue mayor de 8 nmol.L-1 para la [H+] (p<0,001). La
ecuación propuesta puede ser usada para estimar la [H+] en lugar de
la ecuación de Stewart, aunque los valores estimados son significativamente
diferentes a los valores medidos.
PALABRAS CLAVE: ion hidrógeno, diferencia de iones fuertes,
equilibrio ácido-base, lactato, ejercicio a carga constante.
ABSTRACT
The aim of the present study was to simplify the Stewart equation and to
test the validity of the proposed form. Twenty-four men performed a constant
load exercise test for 30 min on a treadmill. Capillary blood samples were
taken at rest, and again 10, 20 and 30 min into the test. Acid-base variables
were measured using a blood-gas analyser and lactate levels were measured enzymatically. The [H+] was calculated using the
Stewart equation: A[H+]4+B[H+]3+C[H+]2+D[H+]+E=0,
and using a proposed, simplified version of this equation: A[H+]2+B[H+]+C=0.
The difference in the mean [H+] results obtained with the two
equations was 0.004 nmol·L-1. However, the difference between the
means of the equation-derived results and the measured values was highly
significant at >8 nmol·L-1
(p<0.001). The proposed equation can be used to estimate [H+]
instead of the full Stewart equation, although the values obtained are
significantly different to those actually measured.
KEY WORDS: acid-base equilibrium, constant load, hydrogen ion, lactate, strong
ions.
1. INTRODUCCIÓN
La explicación tradicional del
equilibrio ácido-base queda reflejada en la ecuación de Henderson-Hasselbach (1). De forma tradicional, el estado ácido-base del
organismo se explica en términos cuantitativos mediante la relación entre pH
plasmático e intensidad del ejercicio. Cuando la intensidad del ejercicio
alcanza un valor determinado, el incremento de la concentración de ácidos en
plasma determina un aumento de la concentración de protones ([H+]), con un descenso de la concentración
de bicarbonato ([HCO3-]) (2). Sin embargo, esta
explicación tradicional, aunque sencilla y de fácil compresión, tiene considerables
limitaciones: en primer lugar, no tiene en cuenta las variaciones que se pueden
producir individualmente en cada uno de los tres compartimentos afectados (intracelular, eritrocitario y plasmático),
cuando aumenta la [H+]; en segundo lugar, no
tiene en cuenta las relaciones entre los tres compartimentos, de manera que las
variaciones en uno de ellos determinan cambios en los otros dos compartimentos.
Las variables independientes que
determinan el equilibrio ácido-base de las soluciones biológicas son: la
presión parcial de dióxido de carbono (PCO2),
la diferencia de iones fuertes ([SID]) (iones orgánicos
e inorgánicos completamente disociados) y la concentración de
ácidos débiles parcialmente disociados ([ATOT])
(3-8). Los principales ácidos débiles que participan en esta variable son las
proteínas y los fosfatos, siendo la albúmina y la globulina las proteínas más
importantes (9). La influencia de estas tres variables en la [H+]
puede ser determinada mediante ecuaciones matemáticas (Stewart
y Fencl) (4), así como con el modelo
simplificado del ion fuerte de Constable (10). Estas
aproximaciones cuantitativas son usadas para explicar el estado ácido-base de
soluciones simples y complejas, y ofrecen una novedosa visión de la fisiopatología
de los desequilibrios ácido-base mixtos (1, 10, 11), siendo muy importante
desde un punto de vista clínico. La ecuación propuesta por Stewart es una
expresión polinómica de 4º grado: A[H+]4
+ B[H+]3 + C[H+]2 + D[H+]
+ E = 0 (3, 12) (ver material y métodos). Solucionar la ecuación de Stewart
presenta la desventaja de tener que utilizar programas matemáticos cuyo uso es complejo.
Debido a la escasa contribución de los coeficientes D y E es posible eliminar
estos coeficientes. Además, la ecuación debe incluir sólo aquellos términos que
sean importantes en la fenomenología del procedimiento (10). Por consiguiente,
el objetivo de este estudio fue simplificar dicha ecuación y analizar la validez
de la misma, comparando los valores de [H+] medidos con los estimados
a través de las ecuaciones de Stewart y simplificada, de muestras de sangre
capilar obtenidas durante un esfuerzo a carga constante.
2. MATERIAL Y MÉTODOS
2.1. SUJETOS
Veinticuatro varones
sanos (26,7±4,9 años de edad; 176,1±6,3 cm de altura y 72,8±6,7 kg de peso
corporal), estudiantes de Ciencias de la Actividad Física
y del Deporte participaron en el estudio. Todos los sujetos estaban
familiarizados con esfuerzos realizados en tapiz rodante y fueron informados de
la naturaleza del estudio, dando su consentimiento por escrito. El estudio fue
realizado según las directrices éticas dictadas en la declaración de Helsinki de la Asociación Médica
Mundial, para la investigación con seres humanos.
2.2. PROTOCOLO
Todos los sujetos
realizaron dos pruebas en tapiz rodante (H/P/COSMOS PULSAR 3P 4.0 ®, h/p/cosmos
sports & medical, Nussdorf-Traunstein,
Alemania). En la primera prueba se utilizó un protocolo incremental de 0,2 km·h-1
cada 12 segundos y una pendiente fija de 1%. La segunda prueba consistió en una
fase estable de 30 minutos, realizada a la carga correspondiente al punto medio
de los umbrales ventilatorios (13-15) localizados en la primera prueba. La medición de la composición y el volumen
del aire espirado se realizó con un equipo Jaeger Oxicon Pro ® (Erich Jaeger,
Alemania).
2.3. MUESTRAS SANGUÍNEAS Y ANÁLISIS
Durante la prueba a carga constante
se obtuvieron muestras de sangre capilar de la yema del dedo en: reposo, minutos
10, 20 y 30 de prueba. En total se obtuvieron 96 muestras sanguíneas. Las
muestras fueron recogidas en capilares heparinizados de
100 µl (heparina equilibrada electrolíticamente). Una parte de la muestra (75
µl) se utilizó para el análisis de los parámetros ácido-base (pH, PCO2,
HCO3-) y de los electrolitos (Na+, K+,
Ca2+ y Cl-). Para ello se utilizó un analizador de gases
en sangre ABL 77 ® (Radiometer Copenhagen,
Dinamarca). El resto de la muestra de sangre capilar (25 µl) se usó para medir la concentración de lactato ([Lac-])
mediante método enzimático, utilizando el analizador YSI 1500 ® (Yellow Springs Instruments Co.,
USA). Ambos analizadores fueron calibrados antes de cada prueba. El analizador
de lactato fue calibrado usando concentraciones conocidas de lactato de 5 y 15
mmol·L-1. El analizador de gases en sangre se calibró
automáticamente siguiendo las instrucciones del fabricante.
2.4. CÁLCULOS
Para calcular la [H+] se
utilizó en primer lugar la ecuación de Stewart (3, 12):
Ecuación 1
A[H+]4
+ B[H+]3 + C[H+]2 + D[H+]
+ E = 0
donde A = 1, B = KA
+ [SID], C = (KA [SID] - [ATOT])
- (Kc · PCO2 + Kw`), D = [KA
(KC · PCO2 + Kw`) + (K3
· KC · PCO2)] y E = KA · K3 · KC · PCO2. La [SID] fue
calculada con los valores de electrolitos obtenidos con el analizador de gases
en sangre y aplicando la siguiente fórmula: [SID] = ([Na+]+ [K+]
+ [Ca2+]) – ([Cl-] + [Lac-]) (4). Para la [ATOT]
se utilizó el valor medio obtenido por otros autores (18,2 mequiv·L-1)
(4, 5). KA (3,0 x 10-7 (equiv·L-1)), KC (2,46
x 10-11 (equiv·L-1)2/Torr), K3 (6,0
x 10-11 (equiv·L-1)), Kw` (4,4 x 10-14
(equiv·L-1)2), son las constantes de disociación de los
ácidos débiles, del ácido carbónico, del bicarbonato y del agua, respectivamente.
Los valores de estas constantes han sido utilizados anteriormente por otros
autores (3-6, 12, 16). Para resolver la ecuación de Stewart se utilizó el
programa Matlab v 7.1.0.246 (MathWorks,
Inc. Natick, USA).
Posteriormente, la [H+]
fue calculada con una ecuación de menor complejidad matemática obtenida a
partir de la simplificación de la ecuación de Stewart. Debido a su probable escasa
contribución en el resultado final, los coeficientes D y E fueron eliminados,
obteniendo la siguiente ecuación:
Ecuación 2
A[H+]4
+ B[H+]3 + C[H+]2 = 0
Simplificando, la ecuación
simplificada propuesta es:
A[H+]2
+ B[H+] + C = 0
2.5. ANÁLISIS ESTADÍSTICO
Para comparar los
valores de pH y [H+] medidos por el analizador de gases en sangre y
los valores estimados mediante la ecuación de Stewart y la ecuación
simplificada propuesta, se realizó un análisis de la varianza (ANOVA) de una
vía. Cuando se encontraron diferencias significativas se realizó un análisis post-hoc Scheffé.
Para comprobar la validez de la ecuación simplificada se realizó un análisis de
regresión lineal, se calculó la correlación de Pearson
y se dibujaron los gráficos para las diferencias de las medias, siguiendo el
procedimiento descrito por Bland y Altman (17), entre los valores de pH y de [H+]
medidos, calculados con Stewart y con la ecuación propuesta. Para hallar la
proporción de varianza explicada de la nueva ecuación se utilizó el coeficiente
de determinación (r2). El análisis estadístico se llevó a cabo
mediante el programa SPSS 12.0 para Windows (SPSS Worldwide
Headquarters, Chicago, IL). El nivel de significación
fue de α < 0,05.
3. RESULTADOS
|
Tabla 1. Datos descriptivos (media ± DE) para la [SID], PCO2 y [Lac-].
DE: Desviación estándar.
|
|
|
[SID]
(mequiv·L-1)
|
[Lac-]
(mmol·L-1)
|
PCO2
(mmHg)
|
|
Reposo
|
39,1 ± 12,15
|
1,52 ± 0,53
|
36,21 ± 3,50
|
|
Min 10
|
32,64 ± 3,58
|
4,87 ± 2,09
|
35,79 ± 3,54
|
|
Min 20
|
33,5 ± 3,93
|
4,85 ± 1,97
|
31,88 ± 2,71
|
|
Min 30
|
34,42 ± 4,20
|
4,31 ± 2,08
|
30,92 ± 3,68
|
Los
valores medios de pH y [H+] medidos obtuvieron diferencias
significativas con los valores calculados por ambas ecuaciones, Stewart y la
ecuación simplificada propuesta. Sin embargo, no hubo diferencias
significativas entre los valores estimados por ambas ecuaciones.
La tabla
1 muestra los valores descriptivos (media ± DE) para la [SID], PCO2 y [Lac-], obtenidos con el analizador
de gases en sangre y el analizador de lactato (ver material y métodos).
La tabla 2 muestra
las medias ± DE del pH y la [H+] medidas, estimadas por la ecuación
de Stewart y estimadas por la ecuación propuesta (ecuaciones 1 y 2
respectivamente).
Los
diagramas de dispersión se muestran en la figura 1. Se obtuvo una alta
correlación entre los valores de [H+] calculados con la ecuación de
Stewart y con la ecuación simplificada (r = 0,999; p<0,001); sin embargo, se obtuvo una correlación menor de 0,50
cuando se compararon los valores de [H+] medidos con los obtenidos
por ambas ecuaciones, Stewart y propuesta (r = 0,491; p<0,001 y r = 0,492;
p<0,001, respectivamente).
Los
valores de pH y [H+] medidos fueron significativamente diferentes de
los valores estimados por ambas ecuaciones, Stewart y la propuesta (tabla 2).
Sin embargo, no existieron diferencias significativas entre los valores de pH y
[H+] calculados con ambas
ecuaciones (tabla 2), en ninguno de los momentos de medida (reposo, minuto 10,
20 y 30 de la prueba). El promedio de la diferencia de las medias entre los
valores de [H+] calculados con la ecuación propuesta y con la de
Stewart fue de 0,004 ± 0,013 nmol·L-1, mientras que el promedio de
la diferencia de las medias entre los valores de [H+] utilizando la
ecuación de Stewart y medidos fue de 8,723 ± 6,032 nmol·L-1,
obteniéndose resultados similares (8,727 ± 6,031 nmol·L-1) al
comparar los valores de [H+] calculados utilizando la ecuación
propuesta y los medidos. En la figura 1 se muestran los gráficos de Bland y Altman para la [H+],
en los que se pueden observar estos resultados.
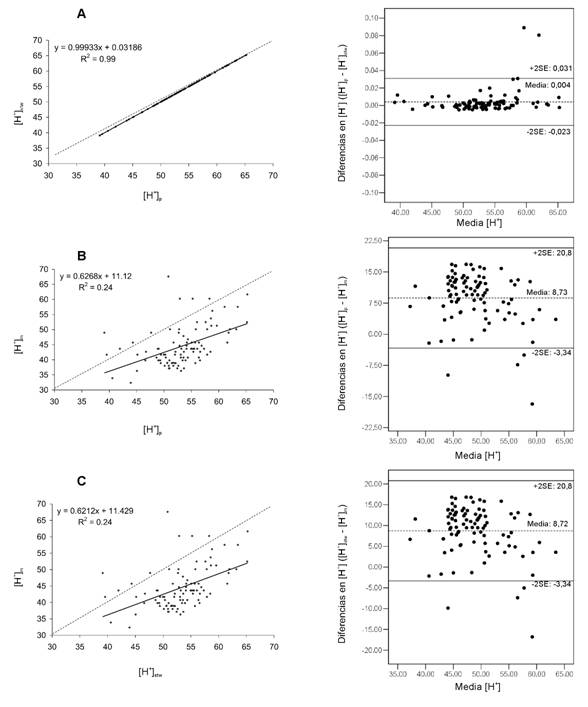
Fig.
1. Los gráficos de la izquierda representan el análisis de regresión lineal
(línea continua) y la línea de identidad para la [H+]. A) Ecuación
de Stewart versus ecuación simplificada propuesta (nmol·L-1). B)
Valores medidos versus ecuación simplificada propuesta (nmol·L-1).
C) Valores medidos versus ecuación de Stewart (nmol·L-1).
4. DISCUSIÓN
La
escasa contribución de los coeficientes D y E en la ecuación de Stewart,
permite eliminarlos y trabajar con una ecuación de segundo grado con la que se
obtienen resultados similares. Los resultados del presente estudio difieren de
los obtenidos por otros autores (4, 6, 18-20). Observamos
diferencias significativas entre la [H+] medida y
estimada por cualquiera de las dos ecuaciones: la ecuación de Stewart y la
ecuación simplificada propuesta. Sin embargo, entre la [H+] estimada
con la ecuación de Stewart y con la ecuación propuesta no hubo diferencias
significativas. El procedimiento de Bland y Altman (17) demostró la validez de la nueva ecuación (fig.
1A), verificándose la utilidad de esta en lugar
de la ecuación de Stewart de mayor complejidad matemática.
Las
diferencias son superiores a 8 nmol.L-1, al comparar los valores
medidos en sangre capilar con los calculados a partir de ambas ecuaciones. Por
el contrario, en el trabajo de Kowalchuk y Scheuermann (1994, 1995) las diferencias entre la [H+]
medida y estimada por la ecuación de Stewart fueron inferiores a 3 nmol.L-1
(2,1± 7,2 nmol.L-1), al igual
que en el estudio de Heenan y Wolfe (2000), realizado
con mujeres gestantes. Estas diferencias, aunque menores que las encontradas en
el presente trabajo, también fueron significativas. Además, obtuvieron una alta correlación entre la [H+]
medida y estimada (r = 0,81) (4), mientras que en el presente estudio la
correlación es inferior a 0,50. Otros autores no han obtenido diferencias
significativas entre los valores medidos y los calculados a través de la
ecuación de Stewart (19, 20), obteniendo una correlación de r = 0,99 (18).
Ninguno de estos autores ha utilizado el procedimiento correcto de Bland y Altman para validar la
ecuación de Stewart. En el presente trabajo, los gráficos de Bland y Altman demuestran el
escaso acuerdo entre los valores medidos y los valores calculados utilizando la
ecuación de Stewart (fig. 1C), así como con la ecuación propuesta (fig. 1B).
Teniendo en cuenta el escaso acuerdo y la baja correlación obtenida en nuestro
estudio (r = 0,49), es posible argumentar que ambas ecuaciones son inadecuadas
para determinar la [H+], aunque la aproximación de Stewart ofrece un profundo conocimiento del estado
ácido-base (22). Las razones que explican por qué la ecuación de Stewart no
sirve para determinar la [H+] son difíciles de concretar, y podrían
estar relacionadas con la imposibilidad de medir todos los iones fuertes o
determinar [ATOT]. Además, la temperatura y la fuerza iónica del
plasma pueden influir en los valores de las constantes de equilibrio (ver más adelante).
A partir
de una [H+] superior a 55 nmol.L-1 en plasma, las
diferencias entre valores medidos y calculados pueden estar sesgados (4), pero
en el presente estudio las diferencias se muestran incluso en valores de
reposo. En el estudio de Kowalchuk y col. (1988) los valores de [H+]
medidos y calculados fueron muy parecidos, a excepción de los valores en reposo
en sangre arterial, donde hubo una gran variabilidad entre sujetos.
Las
razones de las discrepancias entre los resultados de este estudio y los
resultados de estudios similares pueden deberse a diversos factores. En primer
lugar, aunque diferentes trabajos no han mostrado influencias del tipo de
sangre en las medidas ácido-base realizadas (23, 24), nosotros analizamos
muestras de sangre capilar, mientras que en el resto de estudios se trabajó con
sangre venosa (18), venosa arterializada (4) y sangre arterial (16).
En
segundo lugar, no se han medido los ácidos débiles ([ATOT]),
utilizándose para los cálculos el valor medio del estudio de Kowalchuk y Scheuermann (1994,
1995). La concentración total de ácidos débiles ([ATOT]
o [PTOT]) es
la variable independiente que parece tener menor influencia en los resultados,
en comparación con la [SID] y la PCO2 (18). Además, errores en la
medida de los ácidos débiles parecen no influir demasiado en la [H+]
calculada, a valores de [SID] cercanos a 40 mequiv·L-1 (4, 16).
En
tercer lugar, errores al medir las variables independientes que más determinan
la [H+]: PCO2, [SID]. Ambas variables determinan los
coeficientes de la ecuación de Stewart y de la ecuación propuesta. Sin embargo,
los valores obtenidos para estas variables son similares al del resto de
estudios. Aunque los coeficientes D y E han sido eliminados en la ecuación
propuesta, consideramos que su impacto fisiológico es bajo debido a que la PCO2
es la única variable independiente incluida en ellos. La metodología utilizada
para medir el pH, la PCO2, los iones fuertes (Na+, K+,
Ca2+ y Cl-) y el lactato fue
similar a la utilizada por otros autores (4). Kowalchuk
y Scheuermann (1995) señalan que las diferencias
pueden deberse a que no todos los iones fuertes son medidos, siendo el valor de
[SID] impreciso.
Por
último, errores en los valores de las constantes de equilibrio usados para
determinar los coeficientes de la ecuación de Stewart. Se han empleado los
valores utilizados y recomendados en la literatura, que corresponden a una
temperatura de 37º C para el plasma sanguíneo (3, 5, 9, 12). Estas constantes
son dependientes de la fuerza iónica y de la temperatura de la solución, y aunque
la utilización de valores incorrectos se asocia con pequeños errores, el modelo
de Stewart es insensible a errores en la mayoría de las constantes de
disociación (4, 5, 16). En el presente estudio se ha asumido el mismo valor de
las constantes independientemente de la temperatura central y periférica
durante el ejercicio. Aunque el ejercicio se realizó a carga y temperatura
constantes, es probable que la temperatura no fuera la misma al comienzo que a
la finalización del ejercicio. Sin embargo, el efecto del incremento de la
temperatura sobre las constantes para determinar los coeficientes de Stewart es
despreciable en un sentido biológico (25). Además, las variaciones en la
temperatura no explicarían las diferencias entre la concentración de protones
medida y estimada por cualquiera de las dos ecuaciones.
El
procedimiento matemático empleado para resolver el polinomio de Stewart no es
descrito en ninguno de los trabajos revisados, siendo este aspecto importante a
la hora de determinar cuál puede ser la posible causa de las diferencias
encontradas entre la [H+] medida y estimada, al comparar los
resultados de otros estudios y este trabajo.
5. CONCLUSIONES
En
conclusión, ni la ecuación de Stewart ni la versión simplificada propuesta,
parecen dar una estimación válida de la [H+], cuando los resultados
se comparan con los obtenidos experimentalmente. De todas formas, la ecuación
propuesta puede ser usada para estimar la [H+] en lugar de la ecuación
de Stewart, ya que los resultados del presente trabajo demuestran su validez y
menor complejidad. Futuros trabajos en condiciones de acidosis severa, en las
que la [H+] es más alta que la estudiada en el presente trabajo,
demostrarán si las estimaciones realizadas por la ecuación propuesta se
aproximan a los valores medidos.
6. RELEVANCIA FISIOLÓGICA
- El análisis fisico-químico del estado ácido-base de los fluidos
corporales desarrollado por Stewart es utilizado en diferentes campos.
- Resolver la
ecuación de Stewart tiene la desventaja de tener que utilizar softwares específicos para resolver una ecuación de
cuarto grado.
- La contribución
de los coeficientes D y E es pequeña en el resultado final y pueden ser
eliminados de la ecuación, obteniendo una ecuación de segundo grado más
fácil de resolver.
- Ninguna de las
dos ecuaciones (Stewart y simplificada propuesta) son buenas estimadoras
de la [H+].
7. REFERENCIAS BIBLIOGRÁFICAS
1. Constable PD. A simplified strong ion
model for acid-base equilibria: application to horse plasma. J Appl Physiol.
1997 Jul;83(1):297-311.
2. Heigenhauser GJ. A
quantitative approach to acid-base chemistry. Can J Appl Physiol. 1995
Sep;20(3):333-40.
3. Stewart PA. Modern
quantitative acid-base chemistry. Can J Physiol Pharmacol. 1983 Dec;61(12):1444-61.
4. Kowalchuk JM, Scheuermann BW. Acid-base
regulation: a comparison of quantitative methods. Can J Physiol Pharmacol. 1994
Jul;72(7):818-26.
5. Kowalchuk JM, Scheuermann BW. Acid-base
balance: origin of plasma [H+] during exercise. Can J Appl Physiol. 1995 Sep;20(3):341-56.
6. Kowalchuk JM, Heigenhauser GJ,
Lindinger MI, Sutton JR, Jones NL. Factors influencing
hydrogen ion concentration in muscle after intense exercise. J Appl
Physiol. 1988 Nov;65(5):2080-9.
7. Lindinger MI. Origins of [H+] changes
in exercising skeletal muscle. Can J Appl Physiol. 1995 Sep;20(3):357-68.
8. Tuhay G, Pein MC, Masevicius FD,
Kutscherauer DO, Dubin A. Severe hyperlactatemia with normal base excess: a
quantitative analysis using conventional and Stewart approaches. Crit Care.
2008;12(3):R66.
9. Figge J, Rossing TH, Fencl V. The role of serum proteins in acid-base equilibria. J Lab
Clin Med. 1991 Jun;117(6):453-67.
10. Kurtz I, Kraut J, Ornekian V, Nguyen MK.
Acid-base analysis: a critique of the Stewart and bicarbonate-centered
approaches. Am J Physiol Renal Physiol. 2008 May;294(5):F1009-31.
11. Fidkowski C, Helstrom J. Diagnosing
metabolic acidosis in the critically ill: bridging the anion gap, Stewart, and
base excess methods. Can J Anaesth. 2009 Mar;56(3):247-56.
12. Stewart PA. How to understand acid - base:
a quantitative acid - base primer for biology and medicine. New York: Elsevier
North Holland; 1981.
13. Peinado PJ, Di Salvo V, Pigozzi F,
Bermudez AI, Peinado Lozano AB, Calderon Montero FJ, et al. Steady-state
acid-base response at exercise levels close to maximum lactate steady state.
Clin J Sport Med. 2006 May;16(3):244-6.
14. Wasserman K, Whipp BJ, Koyl SN, Beaver WL.
Anaerobic threshold and respiratory gas exchange during exercise. J Appl
Physiol. 1973 Aug;35(2):236-43.
15. Gaskill SE, Ruby BC, Walker AJ, Sanchez
OA, Serfass RC, Leon AS. Validity and reliability of combining
three methods to determine ventilatory threshold. Med
Sci Sports Exerc. 2001 Nov;33(11):1841-8.
16. Fedde MR, Pieschl RL, Jr. Extreme
derangements of acid-base balance in exercise: advantages and limitations of
the Stewart analysis. Can J Appl Physiol. 1995 Sep;20(3):369-79.
17. Bland JM, Altman DG. Statistical
methods for assessing agreement between two methods of clinical measurement.
Lancet. 1986 Feb 8;1(8476):307-10.
18. Weinstein Y, Magazanik A, Grodjinovsky A,
Inbar O, Dlin RA, Stewart PA. Reexamination of Stewart's
quantitative analysis of acid-base status. Med Sci
Sports Exerc. 1991 Nov;23(11):1270-5.
19. Preston RJ, Heenan AP, Wolfe LA.
Physicochemical analysis of phasic menstrual cycle effects on acid-base
balance. Am J Physiol Regul Integr Comp Physiol. 2001 Feb;280(2):R481-7.
20. Kemp JG, Greer FA, Wolfe LA. Acid-base regulation after maximal exercise testing in late
gestation. J Appl Physiol. 1997 Aug;83(2):644-51.
21. Heenan AP, Wolfe LA. Plasma
acid-base regulation above and below ventilatory threshold in late gestation.
J Appl Physiol. 2000 Jan;88(1):149-57.
22. Lindinger MI, Kowalchuk JM, Heigenhauser
GJ. Applying
physicochemical principles to skeletal muscle acid-base status. Am J Physiol Regul Integr Comp Physiol. 2005 Sep;289(3):R891-4.
23. Forster HV, Dempsey JA,
Thomson J, Vidruk E, DoPico GA. Estimation of arterial PO2, PCO2, pH, and
lactate from arterialized venous blood. J Appl Physiol. 1972 Jan;32(1):134-7.
24. Linderman J, Fahey TD, Lauten G, Brooker
AS, Bird D, Dolinar B, et al. A comparison of blood gases and acid-base
measurements in arterial, arterialized venous, and
venous blood during short-term maximal exercise. Eur J Appl Physiol Occup
Physiol. 1990;61(3-4):294-301.
25. Johnson RLJ, Heigenhauser GJF, Hsia CCW,
Jones NL, Wagner PD. Determinants of gas exchange and acid-base balance during
exercise. In: Rowell LB, Shepherd JT, editors. Handbook of
physiology. New York: Oxford University Press; 1996. p.
515 - 84.
Rev.int.med.cienc.act.fís.deporte- vol. 11 - número 41 - marzo 2011 - ISSN: 1577-0354
