Rev.int.med.cienc.act.fís.deporte- vol. 11
- número 42 - junio
2011 - ISSN: 1577-0354
Serdà, B.C.; Monreal, P. y del Valle, A. (2011). Calidad de vida y cáncer de próstata: un programa
progresivo de fuerza-resistencia. Revista
Internacional de Medicina y Ciencias de la Actividad Física y el Deporte vol.
11 (42) pp. 362-383. Http://cdeporte.rediris.es/revista/revista42/artcalidad215.htm
ORIGINAL
CALIDAD DE VIDA Y CÁNCER DE PRÓSTATA: UN PROGRAMA PROGRESIVO DE
FUERZA-RESISTENCIA
QUALITY OF LIFE AND PROSTATE CANCER: A PROGRESSIVE RESISTANCE
STRENGTH PROGRAM
Serdà,
B.C.1; Monreal, P.2 y del Valle, A.2
Grupo de investigación
ECIS. Universitat de Girona (UdG). Spain.
1 Departamento de Enfermería bernat.serda@udg.edu
2 Departamento de Psicología pilar.monreal@udg.edu;
a.delvalle@udg.edu
Código
UNESCO: 3201 Ciencias clínicas
Clasificación
del Consejo de Europa: 11 Medicina del deporte
Recibido 18 noviembre
de 2009
Aceptado 22 diciembre
de 2009
RESUMEN
Este artículo presenta el diseño y la
implementación de un programa progresivo de fuerza-resistencia adaptado al
cáncer de próstata. El modelo base corresponde a la guía de
PALABRAS CLAVE: Programa fuerza-resistencia; Calidad
de vida; Cáncer de próstata; Hipertensión arterial; Incontinencia urinaria.
ABSTRACT
This article presents the design
and implementation of a progressive resistance strength program adapted to
prostate cancer. The initial model corresponds to the guide of the American College
Sports Medicine Position Stand (ACSM, 2009). This program includes the most usual
symptoms related to the illness and its treatments. The study design is quasi-experimental.
The sample is 33 subjects in treatment
phase. Study variables are tumour classification TNM, anthropometric measures, resistance
strength, hypertension, fatigue, incontinence, pain and quality of life. After
24 weeks a significant improvement on resistance strength capacity is observed.
This result is more consistent in lower extremities. Also improves
hypertension, urinary incontinence, pain and quality of life. As a conclusion,
the improvement of the quality of life is mediated by the functional and
physical capacity of the ill person.
KEY
WORDS: Resistance strength program; Quality of life; Prostate
cancer; Hypertension; Urinary incontinence.
INTRODUCCIÓN
El cáncer de próstata es el
cáncer más frecuente en los hombres en muchos países industrializados. En Europa ocupa
el segundo lugar después del cáncer de pulmón. En Cataluña, desde 1996, la
incidencia del cáncer de próstata ha superado al número de casos del cáncer de
pulmón (Pla
Director d'Oncologia, 2008). El principal factor de riesgo es la
edad, aunque se han identificado otras causas observadas como las influencias
ambientales y los estilos de vida (Hsing y Devesa, 2001).
La
media de edad en fase de diagnostico es de 75 años. El porcentaje de
supervivencia relativa a los 5 años es 76,5%. El estado de morbilidad que
generan los tratamientos es muy elevado. Estos factores justifican que,
actualmente, el objetivo prioritario en la intervención sociosanitaria
sea la mejora de
El
impacto de la enfermedad incluye dos fases asimétricas.
El
corpus actual de la investigación científica demuestra que el diseño de un
programa de ejercicio de fuerza-resistencia como terapia complementaria para el
enfermo de cáncer de próstata mejora la calidad de vida del hombre mayor disminuyendo
la situación descondicionamiento físico y psicosocial (Culos-Reed et al., 2007; Segal et al., 2003). La mayoría de programas revisados se
basan en la guía general que recomienda
La
consideración de estos aspectos, facilita la compatibilidad del programa de
fuerza-resistencia con el cáncer de próstata y su promoción para paliar el
descondicionamiento e incapacidad que genera la enfermedad y el tratamiento (Serdà et al., 2009). A partir de un programa de estas
características se observaría una mayor eficacia en el aumento de la capacidad de
fuerza-resistencia muscular y su transferencia en la calidad de los patrones
motores básicos (Latham et
al., 2003; Latham et al., 2004). Esta mejora disminuiría la fatiga, el
proceso de osteopenia y osteoporosis provocados por la asociación de los
factores de edad, tratamiento hormonal e inactividad. Además disminuiría el
riesgo del encadenamiento de caída-fractura-dependencia (Bliuc et
al., 2009) consiguiendo mejorar la calidad de vida y la supervivencia
del hombre mayor con cáncer de próstata (Higano,
2003).
Este
artículo se plantea mostrar dos objetivos:
1.
El
diseño de un programa de ejercicio progresivo de fuerza-resistencia adaptado al
paciente con cáncer de próstata considerando las variables significativas de
los estudios destinados a personas mayores sanas (≥ 65 años) o enfermas
de patología no cancerígena.
2.
El
cambio intrasujeto de las variables físicas,
funcionales y de la calidad de vida conseguido después de 24 semanas del
programa.
MATERIAL Y MÉTODOS
Localidad y participantes
Tras
obtener el informe favorable del comité ético de investigación, el
programa de ejercicio se realizó en el
Hospital de Figueres (España), desde el mes de octubre de 2006 al mes de octubre
de 2007.
Para la inclusión de los sujetos en el programa es
necesario que cumplieran tres condiciones:
1.
Se requiere el diagnóstico histológico de cáncer de
próstata, en cualquier estadio de la patología en fase de tratamiento.
2.
Haber superado el examen médico preinterventivo
en el que declara que el enfermo no presenta ninguna de las contraindicaciones
incompatibles con el programa de ejercicio.
3.
Firmar el consentimiento informado del interesado.
Los
criterios de exclusión son la presencia de cualquier patología que
contraindique la práctica temporal o permanente del ejercicio físico,
destacando como contradicciones absolutas, los grupo III y IV enfermedad cardiaca
según la clasificación de
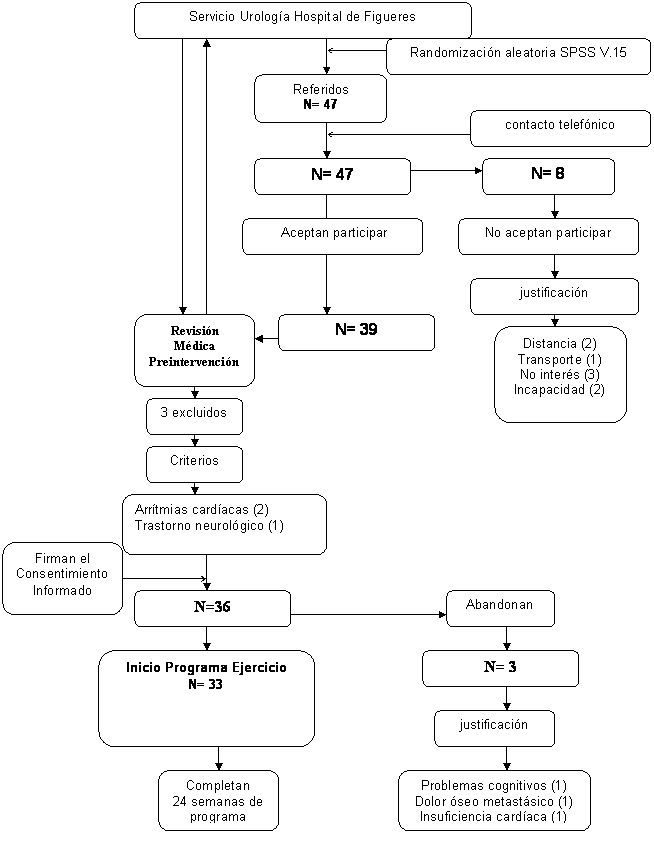
Aleatoriedad en la selección de la muestra
El
diseño del estudio es cuasiexperimental. Inicialmente
se seleccionan 47 sujetos de forma aleatoria a partir de
205 registros de historia clínica referidos
por el Servicio de Urología del Hospital de Figueres. Se utilizó el programa
SPSS v.15 aplicando la función random selection. De los 47 sujetos, 8 decidieron no participar en
el estudio por vivir a gran distancia del Hospital y no disponer de transporte,
falta de interés e incapacidad física. De los 39 sujetos restantes, 3 fueron
excluidos por razones médicas, arritmias cardíacas y trastorno neurológico. De
los 36 participantes que iniciaron el programa 3 abandonaron por problemas
cognitivos, dolor óseo metastásico e insuficiencia cardiaca. La muestra final la formaron 33
participantes. El diagrama de flujo CONSORT representa el procedimiento de la
muestra en el estudio (ver figura 1). La asistencia a las sesiones fue superior
al 93% (30 de 32 sesiones).
Figura 1. Diagrama de flujo CONSORT
INTERVENCIÓN
PROGRAMA DE EJERCICIO
Las
características del programa progresivo de fuerza-resistencia son:
- La duración
de 24 semanas. 16 semanas de control directo a indirecto del profesional de
educación física y 8 semanas de trabajo autónomo.
- La
frecuencia de trabajo es de 2 sesiones semanales de 90 minutos, en las cuales
se incluyen 1 o 2 series de
- Los
ejercicios corresponden al trabajo de la musculatura de: cuadriceps, pectoral, isquiotibiales, deltoides, abdominales (hipopresivos),
bíceps, tríceps, 2 dorsales y musculatura del suelo pélvico. El trabajo del suelo
pélvico incluye tres niveles, primero, la conciencia y el control de la
musculatura, segundo, el refuerzo de la musculatura profunda del suelo pélvico y
tercero, el desbordamiento de energía desde la musculatura sana distante a la
zona muscular del suelo pélvico debilitada.
- La
intensidad de trabajo es del 50% al 70% del 8 RM previamente calculado con el
test de Lander (Lander, 1985).
Es estrictamente obligatorio no sobrepasar el umbral del 70% del 8 RM para
evitar el riesgo de secreción de testosterona (Fleck y Kraemer, 2003). Además se
considera la percepción individual de la intensidad del esfuerzo controlado a
partir de la escala modificada de percepción subjetiva del esfuerzo de Borg CR-10 (Borg, 1990).
- La
progresión ascendente se rige con el incremento consecutivo de repeticiones,
series y peso. Al sobrepasar las 12 repeticiones en la segunda serie se puede
aumentar el peso, siempre y cuando el incremento de peso semanal no sobrepase
el 10% del 8 RM.
- La
adherencia al programa se potenció siguiendo un diseño del modelo de adherencia (Serdà, 2009) construido
a partir de los principales modelos vigentes. El modelo incluye una estrategia
didáctica por fases, que fomenta la autonomía progresivamente, traspasando el
control de la actividad del supervisor al participante. El apoyo contingente
durante el programa permite reforzar las variables más debilitadas. Se
destacan, la percepción de control, la autoeficacia,
la identificación de la dosis terapéutica y la satisfacción que provoca.
Tabla 1. Característiques del
programa setmanal de Fuerza-Resistencia muscular
|
Semanas |
Fase |
Series |
Repeticiones |
Intensidad % 8 RM |
Esfuerzo* |
|
1 |
Base |
1 |
8-12 |
50% |
6-7 |
|
2 |
Inicial |
1 |
8-12 |
60% |
6-7 |
|
3 |
Inicial |
1 |
8-12 |
60% |
6-7 |
|
4 |
Inicial |
2 |
8-12 |
60% |
6-7 |
|
5 |
Progresión |
2 |
8-12 |
60% |
6-7 |
|
6 |
Progresión |
2 |
8-12 |
60% |
6-7 |
|
7 |
Progresión |
2 |
8-12 |
60% |
6-7 |
|
8 |
Progresión |
2 |
8-12 |
70% |
6-7 |
|
9 |
Progresión |
2 |
8-12 |
70% |
6-7 |
|
10 |
Progresión |
2 |
8-12 |
70% |
6-7 |
|
11 |
Supervisado |
2 |
8-12 |
70% |
6-7 |
|
12 |
Supervisado |
2 |
8-12 |
70% |
6-7 |
|
13 |
Supervisado |
2 |
8-12 |
70% |
6-7 |
|
14 |
Autónomo |
2 |
8-12 |
70% |
6-7 |
|
15 |
Autónomo |
2 |
8-12 |
70% |
6-7 |
|
16-24 |
Autónomo |
2 |
8-12 |
70% |
6-7 |
Abreviaturas: * Percepción
de esfuerzo (basado en la escala
de Borg)
VARIABLES ESTUDIADAS
Para
evaluar el cambio intrasujeto se tomaron medidas
pre-test (semana 0) y post-test (semana 24).
En
la evaluación pre-test se tuvo en cuenta la información sobre la experiencia de
la enfermedad incluida en la anamnesis, estadio de la enfermedad según
Las
variables evaluadas pre/post test fueron las siguientes:
- Las
variables antropométricas han seguido el protocolo (AAPHERD,
1988)
y corresponden al peso, el índice de masa corporal, el índice cintura cadera,
el perímetro cintura, la suma de los siete pliegues cutáneos incluyendo
(pectoral, axilar medio, tricipital, subescapular, abdominal,
suprailíaco y muslo) y el porcentaje de masa grasa es
estimada a partir de la fórmula de Jackson y Pollock (Jackson
y Pollock, 1978). El tejido graso visceral abdominal se
evaluó con el CT-escáner.
- La
bioquímica completa procesada en el laboratorio central, evaluó los niveles de
testosterona libre en sangre, lípidos en sangre incluyendo (colesterol total,
lipoproteínas de alta y baja densidad en colesterol y triglicéridos) y los niveles
de Antígeno Prostático Específico (PSA).
-
La capacidad de fuerza-resistencia se estimó a partir del número total de
contracciones musculares completadas a una cadencia de 22 repeticiones/minuto
marcadas por un metrónomo (metrónomo de Korg MA-30)
programado a 44 pulsaciones/minuto con una carga liviana.
-
La fuerza submáxima muscular, se evaluó a partir del
máximo peso que el participante pudo levantar en 8 repeticiones consecutivas
manteniendo una posición higiénica sin descompensarse,
siguiendo el protocolo de
-
El esfuerzo submáximo se valoró a partir de la prueba
del escalón correspondiente al
Test de fitness canadiense modificado (mCAFT)
(Weller et al., 1995) controlado
con la frecuencia, la tensión arterial y la percepción subjetiva del esfuerzo
con la escala de Borg CR-10.
-
La tensión arterial se midió según el procedimiento que especifica la guía de
práctica clínica y material docente de la hipertensión arterial del Institut Català de
-
La intensidad del síntoma de incontinencia se evaluó con la escala visual
analógica categórica que incluye 4 categorías desde 0, no mojado hasta 10, totalmente mojado.
-
La intensidad del dolor se evaluó a partir de la escala visual analógica
numérica. La puntuación está numerada desde 0, no dolor hasta 10, dolor
insoportable.
-
La fatiga se evaluó con el cuestionario FACIT-escala de cansancio (4ª versión). [Rango: 0-52]
- La
calidad de vida se evaluó mediante el cuestionario FACT-P, Functional Assessment Cancer Therapy Scale- Prostate [Rango: 0-156] (4ª versión) (Esper et
al., 1997).
Además,
durante la ejecución del programa se realizó una observación global
estructurada en relación a la ejecución técnica del programa. Para la
observación se utilizó una escala Likert de 4 puntos
e incluyó los aspectos de la postura, la biomecánica de contracción, la función
respiratoria, los patrones motores de la marcha y el escalón [Rango: 0-30]. La
observación garantiza la salud del participante disminuyendo el riesgo de
lesión que conlleva el trabajo. Se realiza una observación
semanal registrada por el experimentador y una cámara de video.
El
momento post-test se evaluó, además de las variables mencionadas anteriormente,
la adherencia al programa. La variable de adherencia se avaluó teniendo en
cuenta el hábito previo al ejercicio físico a partir del
cuestionario de Godin (Godin y Shephard, 1985) y la
práctica autónoma de los ejercicios del programa 8 semanas después de la
finalización del mismo incluyendo las variables del modelo integrado de
adherencia (Serdà, 2009).
CÁLCULO DEL TAMAÑO DE
El
tamaño de la muestra calculada para detectar una diferencia entre grupos de 5,0
puntos es el resultado el test FACT-P (desviación estándar DE:9).
Se aplica el test de dos colas con un riesgo alfa del 5% y un riesgo beta del
.05. El número necesario de participantes es de 33. Para los datos apareados en
las variables continuas que siguen una distribución normal, el test estadístico
utilizado es la t de Student-Fisher con un número de grados de libertad de (n-1).
Para las variables continuas que no siguen una distribución normal se utiliza
el test no paramétrico para datos apareados de Wicolxon
o U de Man Whitney. Para
analizar las variables categóricas se utiliza el test del X2. Se ha
diseñado un modelo multivariante con las dimensiones
que integran el cuestionario de Calidad de Vida. Se han estudiado las variables
del modelo multivariante que resultan significativas
y explican la variación del test de calidad de vida a partir del análisis de
regresión lineal múltiple. Los análisis estadísticos se realizan con el
programa SPSS versión 15. El nivel de significación escogido es del 5%.
RESULTADOS
La
descripción de las características clínicas y epidemiológicas de los participantes
se detalla en la tabla 2.
Tabla 2. Línea base de los
participantes en el estudio
|
Variable |
Grupo
intervención (n=33) |
|
Edad
(años)
|
71,78
(7,22) [55- 83] |
|
Peso (Kg)
|
80,40
(11,60) [64,2 – 111,5]. |
|
IMC (Kg/m2)
|
28,67
(2,99) [24,16 a 33,97 ] |
|
Tensión
Arterial (mm Hg) PAS PAD |
150,25 (21,31) 81,90
(11,03) |
|
Frecuencia
cardiaca reposo (latidos/ minuto)
|
74 (10,74) |
|
Clasificación
tumoral TNM Nº (%) Estadio I Estadio II Estadio
III Estadio IV Desconocido |
0 (0) 13 (39,39) 18 (54,54) 1 (3,03) 1 (3,03) |
|
PSA
diagnóstico (ng/mL)
|
17,95
(24,32) [2,84 - >100] |
|
PSA inicio del programa (ng/mL)
|
0’55
(1,36) [0,01- 5,5]. |
|
Tratamiento
Nº (%) Quirúrgico (P) Hormonal (TDA) Combinado R + TDA P + TDA |
15 (45,45) 15 (45,45) 1 (3,03) 2 (6,06) |
|
Cuestionario sociodemográfico Estado civil Casado/s Viudo/s Soltero/s Situación
laboral Jubilado/s Activos/s |
30 (90,90) 2 (6,06) 1 (3,03) 31 (93,93) 2 (6,06) |
|
Ejercicio
aeróbico previo Nº (%) Cat
1 ≥ 3 veces por semana Intenso Moderado Suave Cat
2 < 2 veces por semana Intenso Moderado Suave |
24
participantes, (72,72%) 1
participante, (3,03 %) 11
participantes, (33,33%) 12
participantes, (36,36%) 9
participantes (27,27) 5
participantes, (15,15%) 4
participantes, (12,12%) |
|
Ejercicio
de fuerza-resistencia previo Nº (%) ≥ 3
veces por semana < 2
veces por semana |
0 (0) 0 (0) 0 (0) |
Abreviaturas: IMC, índice de masa corporal; PAS, presión arterial
sistólica; PAD, presión arterial diastólica; PSA, antígeno prostático
específico; P, prostatectomía; TDA, Terapia de privación androgénica;
R + TDA, radioterapia combinada con terapia de privación androgénica;
P+TDA, prostatectomía con terapia de privación androgénica.
Los
resultados de las variables antropométricas determinan que el perfil del
participante es androide con una concentración de grasa a nivel abdominal. Al
finalizar el programa se observa una disminución significativa en las medias y
desviación típica (Dt) de todas las variables excepto
la del peso (ver tabla 3). Se registra una disminución significativa en cada
uno de los siete pliegues corporales, de todos ellos, los 2 pliegues que
proporcionalmente disminuyen más se circunscriben en el área abdominal y
corresponden concretamente al pliegue suprailiaco,
con una diferencia de la media de 6,22 (Dt 5,29;
P≤,001) y el pliegue abdominal con una diferencia de la media 5,91 (Dt 9,42; P≤,001)
Mientras que, el pliegue que disminuye menos corresponde al pliegue
pectoral 4,75 (Dt 5,29.;P≤,001).
Tabla 3. Descripción antropométrica
|
Variables |
(n) |
Pretest |
Postest |
Pretest-
Postest‡ |
||||
|
|
Dt |
|
Dt |
|
Dt |
p* |
||
|
Peso (Kg) |
33 |
80,40 |
11,60 |
79,92 |
12,08 |
0,478 |
1,89 |
,157 |
|
IMC (Kg/m2) |
33 |
28,67 |
2,99 |
28,20 |
3,06 |
0,46 |
1,02 |
,007* |
|
ICC |
33 |
1,01 |
0,05 |
0,99 |
0,05 |
0,02 |
0,03 |
,003* |
|
PC |
33 |
104,46 |
8,68 |
101,90 |
8,97 |
2,56 |
2,49 |
≤,001* |
|
∑7
pliegues (mm) |
33 |
219,76 |
44,17 |
180,30 |
37,10 |
39,46 |
31,09 |
≤,001* |
|
MG-7 (%) |
33 |
40,87 |
15,18 |
28,96 |
11,42 |
11,90 |
10,59 |
≤,001 |
Abreviaturas: IMC, Índice de Masa Corporal; ICC, Índice Cintura
cadera; PC, perímetro cintura; ∑7 pliegues, Suma de los siete pliegues
corporales; MG-7 (%), Masa de Grasa expresado en porcentaje.
En
relación a los parámetros cardiovasculares de reposo y de esfuerzo se observa
una disminución significativa de todas las variables excepto la presión
arterial diastólica tanto de reposo como de esfuerzo submáximo
(Ver tabla 4).
Tabla 4. Frecuencia cardíaca y presión arterial de reposo
|
Variables |
(n) |
Pretest |
Postest |
Pretest-Postest
‡ |
||||
|
|
Dt |
|
Dt |
|
Dt |
P* |
||
|
FC-R |
33 |
74,00 |
10,74 |
71,96 |
11,59 |
2,03 |
8,79 |
,02* |
|
PAS-R |
33 |
150,25 |
21,31 |
139,96 |
18,65 |
10,28 |
16,16 |
<,001* |
|
PAD-R |
33 |
81,90 |
11,03 |
78,65 |
10,28 |
3,25 |
11,61 |
,062 |
|
FCsubmáx |
24 |
122,83 |
16,98 |
115,58 |
19,51 |
7,25 |
19,42 |
,040* |
|
PASsubmáx |
24 |
180,58 |
22,29 |
172,79 |
25,81 |
7,79 |
20,66 |
,039* |
|
PADsubmáx |
24 |
90,16 |
14,96 |
83 |
9,95 |
7,16 |
16,88 |
,049 |
|
Borgsubmáx |
24 |
5,08 |
1,742 |
4,375 |
1,61 |
,70 |
1,6 |
,02* |
|
VO2 màx |
30 |
16,16 |
8,04 |
22,26 |
5,73 |
6,10 |
5,07 |
<,001* |
Abreviaturas: ‡: Cambios observados a las 24 semanas
del programa de intervención; FCR: Frecuencia cardiaca de reposo (latidos/min);
PAS-R: Presión arterial sistólica de reposo (mmHg);
PAD-R: Presión arterial diastólica de reposo (mmHg).FCsubmáx:
frecuencia cardiaca submáxima (latidos/min); PASsubmáx:
presión arterial sistólica submáxima (mmHg); PADsubmáx: presión arterial diastólica submàxima (mmHg) Borgsubmáx:
Escala de percepción subjetiva del esfuerzo de Borg submáximo; VO2 máx:
consumo máximo de oxígeno [ml kg-1 min -1];
Los cambios
en la resistencia muscular y la fuerza
submáxima (8 RM) se incluyen
en la tabla 5. El porcentaje de aumento de las variables tanto de
la resistencia muscular como
Tabla 5. Fuerza muscular
|
Descripción del parámetro |
Pretest |
Postest |
Pretest-Postest ‡ |
||||||||
|
Variables |
Grupo |
Rango |
(n) |
|
Dt |
|
Dt |
|
Dt |
p* |
|
|
Pretest |
Postest |
||||||||||
|
Rmusc |
Pec |
[2-23] |
[7-42] |
31 |
12,83 |
5,20 |
20,25 |
7,87 |
7,41 |
6,97 |
<,001* |
|
EI |
[8-50] |
[10-90] |
32 |
19,43 |
9,49 |
31,37 |
18,12 |
11,93 |
18,87 |
<,001* |
|
|
8 RM |
Pec |
[5,3-36,5] |
[6,6-45,6] |
32 |
21,66 |
8,38 |
26,59 |
8,91 |
4,93 |
4,37 |
<,001* |
|
EI |
[6,6-135,4] |
[10,7-159,6] |
32 |
57,59 |
35,19 |
83,79 |
43,33 |
26,19 |
24,78 |
<,001* |
|
Abreviaturas: Rmusc: resistencia muscular; 8 RM: fuerza submáxima, calculada mediante las fórmulas de Lander, J. (1) (Lander, 1985); Pec: pectoral; EI:
extremidades inferiores; ; ‡: Cambios observados a las 24 semanas del programa
de intervención; p* Valor de significación p ‹ ,05.
Se
observa una mejora significativa de la fuerza-resistencia muscular y la fuerza submáxima. El efecto es mayor en las extremidades
inferiores (Ver tabla 7). Fórmula de Lander (1985):
Carga levantada (Kg) / [1,013 -0,0267123 NR ].
La
media de
En
relación a los síntomas relativos a la enfermedad, con el programa se observa una disminución
significativa de los síntomas de incontinencia y dolor, mientras que la mejora
de la fatiga no es significativa (ver tabla 6).
Tabla 6. Cambios en las medias y desviación típica de la incontinencia
urinaria, la fatiga y el dolor.
|
Descripción del parámetro |
Pretest |
Postest |
Diferencias
relacionadas‡ |
||||||
|
Cuestionario |
Rango |
(n) |
|
Dt |
|
Dt |
|
Dt |
p* |
|
EVA-IU |
[0-10] |
33 |
3,79 |
2,54 |
1,03 |
.918 |
2,75 |
1,88 |
,000* |
|
FACIT |
[0-52] |
33 |
39,91 |
9,72 |
42,90 |
6,60 |
2,99 |
10,46 |
,110 |
|
EVA- D |
[0-10] |
33 |
4,57 |
2,41 |
2,66 |
1,79 |
1,90 |
1,25 |
≤,001 |
Abreviaturas: EVA- IU: escala visual analógica de la incontinencia
urinaria; FACIT: cuestionario de fatiga; EVA-D: escala visual analógica del dolor;![]() :
media; Dt: desviación típica; ‡: cambios observados a
las 24 semanas de programa de intervención. p*: valor de
significación P ‹ ,05.
:
media; Dt: desviación típica; ‡: cambios observados a
las 24 semanas de programa de intervención. p*: valor de
significación P ‹ ,05.
Cuando
analizamos los resultados del cuestionario de calidad de vida (FACT-P)
pre/post-test observamos un aumento significativo en la media de 9,39 puntos (Dt de 16,55; p ,003* ).
Para explorar la relación existente entre el síntoma de IU y la mejora de ![]() =14,75)
es superior estadísticamente a la media (
=14,75)
es superior estadísticamente a la media (![]() =2,95)
de los pacientes que tienen menos mejora de
=2,95)
de los pacientes que tienen menos mejora de
Considerando el modelo multivariante de las
dimensiones que integran el cuestionario de la calidad de vida FACT-P.
Se realizó la regresión lineal múltiple con el objetivo de analizar las
diferencias obtenidas entre el valor post-intervención y el valor
pre-intervención, tanto en el valor total del test de calidad de vida como de
cada una de las dimensiones. Además, se consideró el coeficiente ß de cada
variable independiente con el objetivo de interpretar el signo de forma que, si
es positivo aumenta el valor de la variable y si es negativo disminuye. Las
variables del modelo multivariante que resultan
significativas y explican la variación en la puntuación del test de CdV son: El estado físico general de salud, el estado
emocional y la dimensión de los síntomas relativos al cáncer de próstata. Las
dimensiones no significativas son el ambiente familiar y social y la escala de
fatiga.
Tabla 7. Dimensiones
cuestionario FACT
|
|
T |
ß |
P* |
|
1.- PWB:
estado físico general de salud. |
2,528 |
,249 |
,018 |
|
2.- SWB:
ambiente familiar y social. |
1,170 |
,122 |
,252 |
|
3.- EWB:
estado emocional. |
3,769 |
,404 |
,001 |
|
4.- PCS:
otras preocupaciones. |
3,909 |
,365 |
.001 |
|
5.- FACIT:
escala de fatiga. |
-3,19 |
-,028 |
,752 |
|
R2
=,933% |
|
|
|
Tabla 8. Dimensiones
cuestionario FACT-P
|
|
T |
ß |
P* |
|
1.- PWB:
estado físico general de salud. |
3,32 |
,285 |
,002 |
|
3.- EWB:
estado emocional. |
4,54 |
,419 |
,000 |
|
4.- PCS:
Síntomas. |
4,56 |
,404 |
.000 |
PCS: en el cuestionario de Calidad de vida
corresponde a Otras preocupaciones, atribuido
a los síntomas relativos a la enfermedad y al tratamiento.
Al evaluar
la adherencia de los participantes al programa utilizando el modelo integrado
se constató un 100% de
adherencia a la actividad en
la semana 24. Los participantes informaron que el mantenimiento de la conducta
autónoma de ejercicio estaba mediado por la percepción de mejora en el síntoma
de incontinencia y el dolor, además del bienestar general post-entrenamiento. Las
variables de percepción de control, autoeficacia, el
conocimiento de la dosis terapéutica, la distracción psicosocial y la fuerza de
voluntad se identificaron como decisivas para el mantenimiento de la conducta a largo término.
Los
resultados derivados de la unidad de observación global estructurada mostraron
que len la fase inicial (semanas 1-6) la puntuación media fue de 12,5 puntos,
mientras que el resultado de la fase autónoma (semanas 18-24) fue de 24 puntos.
Destacamos la mejora en la calidad de los patrones motores básicos, destacando
la coordinación en el ascenso y descenso del escalón en el test aeróbico submáximo mCAFT.
DISCUSIÓN
La
descompensación antropométrica, metabólica y cardiovascular es habitual entre
los hombres de cáncer de próstata. Este efecto está provocado por el déficit de
secreción de testosterona (Traish et
al., 2009b). El fenotipo pretest del
participante corresponde a
La mejora de la eficacia cardiovascular se detecta a
partir de la disminución de las variables: frecuencia cardiaca, tensión
arterial, percepción subjetiva del esfuerzo tanto en situación de reposo como
en esfuerzo submáximo. En el postest
mejora la capacidad de trabajar a una intensidad de esfuerzo mayor con una
recuperación cardiovascular postesfuerzo más eficaz.
Se registra un descenso gradual de la tensión arterial que es evidente y
significativo a partir de la sexta semana del programa. Al finalizar la fase
experimental el subgrupo de personas hipertensas se reduce el 50% mediado por
el descenso de la presión arterial sistólica. De acuerdo con los resultados se
confirma que el programa tiene un efecto hipotensor significativo en la presión
arterial sistólica del subgrupo de hombres hipertensos aunque no podemos
confirmar que el efecto se mantenga a largo término. La mejora registrada en la
respuesta cardiovascular del enfermo de cáncer de próstata corrobora el
principio de relación entre capacidades. En este sentido, la mejora en la
capacidad de fuerza detectada con las variables fuerza-resistencia y fuerza-submáxima generan la adaptación en la capacidad aeróbica
registrada con las variables de eficacia cardiovascular en estado de reposo y
en situación de esfuerzo submáximo mCAFT. El comportamiento de las variables evidencia una
disminución del estrés cardiovascular con un mayor trabajo resultante y una
menor percepción subjetiva del esfuerzo. Se deben realizar más estudios en esta
línea para cuantificar la relación entre la dosis exacta de actividad de fuerza
y su efecto en la salud cardiovascular.
La mejora del perfil antropométrico y de la
respuesta cardiovascular descrita es determinante en la mejora de los factores
interrelacionados con el síndrome metabólico. Este efecto se identifica con el
análisis conjunto derivado de la disminución de las variables del perfil de
lípidos en sangre, tensión arterial de reposo y en actividad, reducción de la
obesidad abdominal y mejora de la glucemia, lo que implica una mayor
sensibilidad a la insulina (Dunstan et
al., 2002). Estos resultados coinciden con los de Warburton y confirman la mejora del síndrome metabólico
correlaciona con la mejora de la dimensión funcional y
La
mejora registrada en las variables de fuerza submáxima
y fuerza-resistencia es ineludible. De acuerdo con Liu
y Latham (Liu y Latham, 2009) observamos que el aumento de fuerza
tiene un efecto de retroacción positiva, de forma que revierte y transfiere en
la capacidad, la ejecución técnica y la calidad de los patrones motores básicos
de la marcha y el ascenso-descenso del escalón. Este resultado se confirma
tanto con el análisis de los cambios identificados en los registros periódicos
de la unidad de observación global estructurada como en los resultados del test
submáximo aeróbico mCAFT.
La
mejora registrada en fuerza-resistencia es superior a
El
resultado de incremento de la capacidad de fuerza correlaciona con el freno del
proceso catabólico del sistema muscular, mejora el estado de sarcopenia que se agrava y perpetúa con la enfermedad del
cáncer. La recuperación tanto de la masa muscular como la intensidad y calidad
de contracción muscular genera un arco de movimiento eficaz. Estos factores
concretos determinan la mejora general de la funcionalidad, en la habilidad y
en el movimiento que exigen las actividades de la vida diaria, retardando la
manifestación de fatiga y mejorando la salud percibida de las personas mayores (Salem et al., 2000; Warburton
et al., 2001; Ringsberg et
al., 1999).
Los
resultados de los estudios describen una relación directamente proporcional
entre el trabajo de fuerza muscular y la densidad mineral ósea. Este efecto
también se identifica en personas mayores, aunque la magnitud del cambio
depende del estado inicial de la estructura (Warburton
et al., 2001).
En
contrapartida, el trabajo de fuerza en personas mayores tiene un mayor riesgo
de sufrir lesiones de las partes blandas, principalmente en las inserciones tendinosas
(Kolt et
al., 2004). Este riesgo aumenta en el subgrupo
de personas enfermas. Este factor justifica la importancia de calibrar la dosis
de trabajo eficaz para conseguir el máximo beneficio en la estructura ósea y
muscular, minimizando el riesgo de lesión (Gregg et
al., 2000). Los estudios revisados estiman que la
duración mínima del programa de fuerza para conseguir el aumento de la densidad
mineral ósea es de 24 semanas (Wolff et
al., 1999).
La gestión de este parámetro concuerda con el diseño de nuestro
programa, superando una de las limitaciones metodológicas identificadas en
otros programas similares (Segal et
al., 2003). Los resultados observados justifican el efecto del
trabajo de fuerza sobre la salud ósea, aunque no se debe olvidar la promoción
de la correcta alimentación con ingesta de calcio. (Evans, 1998). La disminución de la capacidad músculo-esquelética y
sobretodo en las extremidades inferiores correlaciona con la tríada caída,
fractura y dependencia de la persona mayor. Este riesgo aumenta enormemente en
la persona frágil (Fiatarone
et al., 1993; Tinetti y Williams, 1998). El impacto resultante de la caída sobre el hueso osteoporótico, habitualmente causa una fractura, con la
consecuente pérdida de movilidad y con el riesgo de generar el síndrome
post-caída como consecuencia una situación de dependencia funcional (Buchner et
al., 1997).
La
mejora osteomuscular permite a la persona mayor
mantener la autonomía retardando el riesgo de situarse en la zona umbral de
dependencia que habitualmente provoca la enfermedad y el tratamiento de cáncer.
A partir del entrenamiento
de fuerza programado, se observa un efecto inicial de condicionamiento muscular
y posteriormente un aumento de la salud ósea. Una mejora del estado de salud osteomuscular retarda el riesgo de entrar en la zona umbral
de de dependencia habitual en las personas mayores tratadas de cáncer (Kamel et
al., 2003; Kamel, 2003; Suh y Lyles, 2003).
Además, el
programa consigue disminuir, controlar y revertir los síntomas de
incontinencia, fatiga y dolor. El efecto se consigue por la capacidad que
ofrece el programa de adaptación flexible a los síntomas más habituales
asociados a la enfermedad y sus tratamientos. Por ejemplo, considerando el
síntoma de incontinencia, el programa de fuerza incluye la gestión de tres
fases consecutivas correspondientes a la sensopercepción
del suelo pélvico, el reforzamiento y finalmente los ejercicios de
desbordamiento irradiados desde la musculatura sana hacia la musculatura
atrofiada y dañada del suelo pélvico. Este modelo organizado por fases y
adaptado al síntoma de incontinencia consigue mejorar de forma significativa
Desde la
fase inicial del programa se ha realizado el estudio contextualizado para la
promoción multidisciplinar de las variables que correlacionan con la adherencia.
La piedra angular del estudio son las personas mayores afectadas de cáncer de
próstata y su entorno sociofamiliar. Desde esta perspectiva, se entiende a la
adherencia como un proceso y no como un valor final del estudio. Por este motivo en la fase experimental se ha
ofrecido el apoyo contingente requerido en relación a las variables más débiles
relativas a la percepción de control, la autoeficacia,
la percepción de mejora, el conocimiento de la dosis terapéutica. Esta
consideración ha favorecido el mantenimiento autónomo de la actividad una vez finalizada
la fase experimental, consiguiendo una adherencia del 100% de la muestra.
Los
resultados reafirman la controversia sobre
la eficacia del screening y diagnóstico del cáncer de próstata a partir del
test del PSA en el cribaje poblacional (Schroder et al., 2009; Andriole
et al., 2009). También nos planteamos la cuestión
sobre la necesidad de tratamiento del cáncer de próstata de bajo riesgo. Esta
afirmación se justifica por el encadenamiento de factores riesgo
observados de forma conjunta o secuencial que determinan el síndrome
metabólico del hombre mayor tratado de cáncer de próstata. En este estudio
identificamos el perfil graso, la hipertensión arterial (con hipertensión
sistólica aislada), la frecuencia cardiaca de reposo elevada, el colesterol, el valor elevado de
lipoproteínas de alta densidad, la dieta excesiva en grasas saturadas y la
conducta sedentaria. La combinación de estos factores eleva el riesgo de
enfermedad cardiovascular (Traish et
al., 2009a). Si a este perfil además le añadimos los efectos
secundarios propios de la enfermedad y sus tratamientos como, la incontinencia
urinaria, disfunción e impotencia sexual, la fatiga, el distrés,
aislamiento social...etc determina que el impacto del
tratamiento del cáncer de próstata en
CONCLUSIONES
-
A
partir del programa de fuerza programado mejora la capacidad de
fuerza-resistencia y la fuerza submáxima. La mejora
general de la fuerza es superior en las extremidades inferiores que en el
tronco. Se observa una transferencia de la fuerza en la capacidad aeróbica y en
la habilidad de los patrones motores básicos. La mejora de la dimensión
funcional retroalimenta el resto de dimensiones de la CdV.
-
El
programa consigue disminuir el riesgo cardiovascular del enfermo. Este efecto
se determina por la disminución de las variables antropométricas,
principalmente por la disminución del porcentaje de tejido graso de la zona
abdominal y la disminución de la tensión arterial.
-
El
programa tiene un efecto hipotensor más evidente en la población hipertensa.
Este efecto es significativo en la presión arterial sistólica y a partir de la
sexta semana de programa.
-
Los
resultados justifican la capacidad de adaptación flexible del programa a los
síntomas de incontinencia urinaria, fatiga y dolor. La disminución de la
intensidad de los síntomas median en la mejora de la calidad de vida del
enfermo.
-
Los resultados confirman que el programa de
fuerza-resistencia es
válido, sostenible y es la mejor forma de intervención destinada al hombre
mayor afectado de cáncer de próstata. Este tipo de programa permite el control
directo de las constantes vitales, disminuye el riesgo de disfunción
cardiovascular, disnea y caída. Además, permite la atención inmediata en caso
de urgencia.
-
En virtud de los resultados queda demostrado que el
ejercicio de fuerza resistencia mejora significativamente
BIBLIOGRAFÍA
AAPHERD (1988). The American
Alliance Physical Fitness Education y Assessment Program. American
Alliance for Health, Physical Education,
Recreation, and Dance
(AAPHERD).
ACSM (1998). American College of Sports Medicine Position Stand. Exercise and physical activity for older adults 5. Med.Sci.Sports Exerc., 30, 998-1008.
ACSM (2009). American College of Sports Medicine Position Stand. Exercise and physical activity for older adults 5. Med.Sci.Sports Exerc., 41, 2 459-471.
Andriole, G. L., Crawford,
E. D., Grubb, R. L., III, Buys, S. S., Chia, D., Church, T. R. et al.
(2009). Mortality results from a randomized prostate-cancer screening trial. N.Engl.J.Med., 360, 1310-1319.
Amado Guirado,
E.(2003). Hipertensió arterial. Guies de pràctica clínica i material docent, 6, 1-97.
American Society
of Clinical Oncology (2008).
An examination into quality
of life as a prognostic survival indicator. Results of a meta-analysis of over 10,000 patients covering 30 EORTC clinical trials.J Clin Oncol 26: (May 20 suppl; abstr 9516)
Bellizzi, K. M., Latini,
D. M., Cowan, J. E., Duchane,
J., y Carroll, P. R. (2008). Fear of Recurrence, Symptom Burden, and Health-Related Quality of Life in Men with Prostate Cancer.
Urology.
Bliuc, D., Nguyen,
N. D., Milch, V. E., Nguyen,
T. V., Eisman, J. A., y Center,
J. R. (2009). Mortality risk
associated with low-trauma osteoporotic fracture and subsequent fracture in men and women. JAMA, 301,
513-521.
Borg, G. (1990). Psychophysical scaling with applications in physical work and the perception of exertion 5. Scand. J.Work Environ.Health, 16 Suppl 1,
55-58.
Brown, E. y Weir, P. (2001). Journal of Exercise
Physiology-online [On-line].
Available: http://faculty.css.edu/tboone2/asep/Brown2.doc.
Consultado 21/12/2009
Buchner, D. M. (1997). Physical activity and quality of life in older adults. JAMA, 277, 64-66.
Buchner, D. M., Cress,
M. E., de Lateur, B. J., Esselman,
P. C., Margherita, A. J., Price,
R. et al. (1997). The effect of strength
and endurance training on gait, balance, fall risk, and health services use in community-living older adults. J.Gerontol.A Biol.Sci.Med.Sci.,
52, M218-M224.
Cella, D. F. (1995). Measuring quality of life in palliative care
11. Semin.Oncol., 22, 73-81.
Cella, D. F. & Tulsky, D. S. (1993). Quality of life in cancer: definition, purpose, and method of measurement 2. Cancer Invest, 11,
327-336.
Courneya, K. S. (2001). Exercise interventions during cancer treatment:
biopsychosocial outcomes 9.
Exerc.Sport Sci.Rev., 29,
60-64.
Courneya, K. S., Segal,
R. J., Mackey, J. R., Gelmon,
K., Reid, R. D., Friedenreich, C. M. et al. (2007). Effects of aerobic and resistance exercise in breast cancer patients
receiving adjuvant chemotherapy:
a multicenter randomized controlled trial. J.Clin.Oncol., 25,
4396-4404.
Culos-Reed, S. N., Robinson, J. L., Lau, H., O'Connor, K., y Keats, M. R. (2007). Benefits of
a physical activity intervention for men with prostate cancer
2. J.Sport Exerc.Psychol.,
29, 118-127.
Departament de Sanitat i
Seguretat Social (2008). Pla Director d'Oncologia en Catalunya: 2008-2010.
Institut Català d’Oncologia. Accesible en http://www.iconcologia.net/catala/pla_director/index.htm consultado
21/12/2009.
Dunstan, D. W., Daly,
R. M., Owen, N., Jolley, D., De Court,
Shaw, J. et al. (2002). High-intensity
resistance training
improves glycemic control in older
patients with type 2 diabetes. Diabetes Care, 25,
1729-1736.
Esper, P., Mo,
F., Chodak, G., Sinner, M.,
Cella, D., y Pienta, K. J. (1997). Measuring quality of life in men with
prostate cancer using the functional
assessment of cancer therapy-prostate instrument. Urology, 50, 920-928.
Evans, W. J. (1998). Exercise and nutritional needs of elderly people: effects on muscle and bone. Gerodontology., 15,
15-24.
Fallowfield, L. (2008). The quality of life: The missing measurement in health care. London: Horizon books.
Ferrans, C. E. (1996). Development of a conceptual model of quality
of life
1. Sch Inq.Nurs.Pract.,
10, 293-304.
Fiatarone, M. A., O'Neill,
E. F., Doyle, N., Clements, K. M., Roberts, S. B., Kehayias,
J. J. et al. (1993). The Boston FICSIT study: the effects of resistance training and nutritional supplementation on physical frailty in the oldest old.
J.Am.Geriatr.Soc., 41, 333-337.
Fleck, S. y Kraemer,
W. (2003). Designing Resistance training Programs. (Champaign ed.) Human Kinetics Publishers.
Godin, G. y Shephard,
R. J. (1985). A simple method to assess
exercise behavior in the community 27. Can.J.Appl.Sport Sci., 10,
141-146.
Gregg, E. W., Pereira, M. A., y Caspersen, C. J. (2000). Physical
activity, falls, and fractures among
older adults: a review of the epidemiologic evidence
4. J.Am.Geriatr.Soc., 48, 883-893.
Higano, C. S. (2003). Management of bone loss in men
with prostate cancer. J.Urol., 170,
S59-S63.
Hsing, A. W. y Devesa, S. S.
(2001). Trends and patterns
of prostate cancer: what do they suggest?
3. Epidemiol.Rev., 23, 3-13.
Jackson, A. S. y Pollock, M. L. (1978). Generalized
equations for predicting body density of men 21. Br.J.Nutr., 40,
497-504.
Jiménez, A. (2008). Application of the 1rm estimation formulas from the rm
in bench press in a group of physically active middle-aged women. Journal of Human Sport and Exercise online [On-line].
Joint National Comittee
on Detection, E. a. t. o. H. P. J. V. (1997). The Sixth Report of the Joint National Comittee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure.
Arch Intern Med, 21,
2413-2446.
Kamel, H. K. (2003). Sarcopenia and aging. Nutr.Rev., 61, 157-167.
Kamel, H. K., Iqbal,
M. A., Mogallapu, R., Maas,
D., y Hoffmann, R. G. (2003). Time to ambulation after hip fracture surgery:
relation to hospitalization
outcomes. J.Gerontol.A Biol.Sci.Med.Sci., 58, 1042-1045.
Kolt, G. S., Hume, P. A., Smith, P., y Williams, M. M. (2004). Effects
of a stress-management program
on injury and stress of competitive gymnasts. Percept.Mot.Skills, 99, 195-207.
Korfage, I. J., Hak,
T., de Koning, H. J., y Essink-Bot,
M. L. (2006). Patients' perceptions
of the side-effects of prostate cancer treatment--a qualitative interview study. Soc.Sci.Med., 63, 911-919.
Lander, J. (1985). Maximum based reps. NSCA Journal, 60-61.
Latham, N., Anderson, C., Bennett, D., y Stretton, C.
(2003). Progressive resistance
strength training for physical disability in older people
6. Cochrane.Database.Syst.Rev., CD002759.
Latham, N. K., Bennett,
D. A., Stretton, C. M., y Anderson, C. S. (2004). Systematic review of progressive resistance strength training in older adults 4. J.Gerontol.A Biol.Sci.Med.Sci., 59, 48-61.
Liu, C.; Latham,
N.K. (2009). Progressive resistance strength training for improving physical function in older adults (review). Wiley & Sons. NY.
Martínez-Hervas, S. (2008). Perímetro cintura y factores de riesgo
cardiovascular. Revista Española de Obesidad, 6, 97-104.
Palmer, M. H., Fogarty, L. A., Somerfield, M.
R., y Powel, L. L. (2003). Incontinence after prostatectomy: coping with incontinence
after prostate cancer surgery. Oncol.Nurs.Forum, 30, 229-238.
Ringsberg, K., Gerdhem,
P., Johansson, J., y Obrant, K. J. (1999). Is there a
relationship between balance, gait performance
and muscular strength in 75-year-old women? Age Ageing, 28, 289-293.
Salem, G. J., Wang, M. Y., Young, J. T., Marion,
M., y Greendale, G. A. (2000). Knee
strength and lower- and higher-intensity functional performance in older adults. Med.Sci.Sports Exerc., 32,
1679-1684.
Schroder, F. H., Hugosson,
J., Roobol, M. J., Tammela,
T. L., Ciatto, S., Nelen,
V. et al. (2009). Screening and prostate-cancer mortality in a randomized European study. N.Engl.J.Med., 360, 1320-1328.
Segal, R. J., Reid, R. D., Courneya, K. S., Malone, S. C., Parliament,
M. B., Scott, C. G. et al. (2003). Resistance exercise in men receiving androgen deprivation therapy for prostate cancer. J.Clin.Oncol., 21,
1653-1659.
Segal, R.J.,
Reid,R.D., Courneya K.S., Sigal, R.J.,
Kenny, G.P., Prud' Homme D.G.,
Malone, S.C., et al. (2009). Randomize controlled trial of resistance or
aerobic exercise in men receiving radiation
therapy for prostate cancer. Journal of clinical oncology 27,3 344-351.
Serdà, B. (2009). Evaluación de los efectos
de un programa de ejercicio físico
individualizado sobre la calidad
de vida, la incontinencia urinaria,
la fatiga y la resistencia muscular con enfermos de cáncer de próstata. Tesis Doctoral. Universitat de Girona. http://www.tesisenxarxa.net/TDX-0724109-105044/ Consultado
12/12/2009
Serdà, B., Monreal, P., y Del
Valle, A. (in press). Estudio de la relación entre el ejercicio físico, el cáncer y la calidad de vida: una revisión bibliográfica y conceptual. Revista de Psicología del Deporte.
Suh, T. T. y Lyles,
K. W. (2003). Osteoporosis considerations in the frail elderly.
Curr.Opin.Rheumatol., 15, 481-486.
Tinetti, M. E. y Williams, C. S.
(1998). The effect of falls and fall injuries on functioning in community-dwelling
older persons. J.Gerontol.A Biol.Sci.Med.Sci.,
53, M112-M119.
Traish, A. M., Saad, F., Feeley, R. J., y Guay, A.
(2009a). The dark side of testosterone deficiency: III.
Cardiovascular disease. J.Androl, 30, 477-494.
Traish, A. M., Saad, F., y Guay, A. (2009b). The dark side of testosterone deficiency: II. Type 2 diabetes and insulin resistance 2. J.Androl, 30,
23-32.
Warburton, D. E., Gledhill,
N., y Quinney, A. (2001). Musculoskeletal
fitness and health 12. Can.J.Appl.Physiol, 26, 217-237.
Weller, I. M., Thomas, S. G., Gledhill, N., Paterson, D., y Quinney, A. (1995). A study to validate the modified
Canadian Aerobic Fitness
Test 1 Can.J.Appl.Physiol, 20, 211-221.
Wolff, I., van Croonenborg,
J. J., Kemper, H. C., Kostense,
P. J., y Twisk, J. W. (1999). The effect
of exercise training programs on bone mass: a meta-analysis of published controlled trials in pre- and postmenopausal women. Osteoporos.Int., 9,
1-12.
Rev.int.med.cienc.act.fís.deporte- vol. 11
- número 42 - junio
2011 - ISSN: 1577-0354