 Pussieldi, G.A.; Veneroso, C.E.; De
Paz, J.A. y Teixeira, M.M. (2018) Respuesta
inflamatoria y antiinflamatoria tras el esfuerzo agudo en natación / Inflammatory and Anti-inflammatoy
Response After Swimming Acute Effort. Revista Internacional de Medicina y Ciencias de la Actividad Física y
el deporte vol. 18 (71) pp. 413-421 Http://cdeporte.rediris.es/revista/revista71/artrespuesta931.htm
Pussieldi, G.A.; Veneroso, C.E.; De
Paz, J.A. y Teixeira, M.M. (2018) Respuesta
inflamatoria y antiinflamatoria tras el esfuerzo agudo en natación / Inflammatory and Anti-inflammatoy
Response After Swimming Acute Effort. Revista Internacional de Medicina y Ciencias de la Actividad Física y
el deporte vol. 18 (71) pp. 413-421 Http://cdeporte.rediris.es/revista/revista71/artrespuesta931.htm
DOI: http://dx.doi.org/10.15366/rimcafd2018.71.001
ORIGINAL
RESPUESTA INFLAMATORIA Y
ANTIINFLAMATORIA TRAS EL ESFUERZO AGUDO EN NATACIÓN
INFLAMMATORY AND ANTINFLAMMATOY
RESPONSE AFTER SWIMMING ACUTE EFFORT
Pussieldi, G.A.1;
Veneroso, C.E.2; De Paz, J.A.3 y Teixeira, M.M.4
1 Profesor Doctor de la Universidade Federal de Viçosa, Campus Florestal, Instituto de Ciências
Biológicas y de la Salud, Grupo de Estudos em Bases Biológicas em Atividade
Física e Saúde (Brasil) guilhermepussieldi@ufv.br
2 Profesor Doctor de la Universidade Federal
do Maranhão, Departamento de Educación Física (Brasil) cveneroso@hotmail.com
3 Profesor
Doctor de la Universidad de León, Faculdad de
Ciencias de la Actividad Física y del Deporte, Instituto de Ciéncias
Biomédicas (España) japazf@unileon.es
4 Profesor
Doctor de la Universidade Federal de Minas Gerais,
Departamento de Bioquímica e Imunologia, Instituto de
Ciências Biológicas (Brasil) mmtex.ufmg@gmail.com
Código UNESCO / UNESCO Code: 241106 Fisiología del Ejercicio / Exercise Physiology
Clasificación Consejo de Europa: 2. Bioquímica del Deporte; Biochemistry of sport
Recibido 26 de junio de 2016 Received
June 26, 2016
Aceptado 13 de septiembre de 2017 Accepted September
13, 2017
RESUMEN
El objetivo del estudio fue analizar la respuesta inflamatoria y
antiinflamatoria a un esfuerzo agudo e intenso de natación, durante la fase
preparatoria para los campeonatos nacionales absolutos brasileños. Participaron
20 nadadores. Se determinaron las concentraciones plasmáticas de IL-6, TNF-α, sTNFR1, IP-10 y MCP-1, antes y 40 minutos después de 2 series de 4
repeticiones de 50 metros nadados a la máxima intensidad con 3 minutos de
recuperación entre cada repetición y una recuperación activa nadando 1500m a
intensidad suave después de cada una de las dos series. En respuesta al ejercicio agudo únicamente la
concentración sTNFR1 se redujo, no presentando cambios en IP-10, IL-6 ni TNF-α. Por tanto el ejercicio agudo en
natación en personas bien entrenadas no parece producir una respuesta
inflamatoria.
PALABRAS CLAVE:
natación, citoquinas, quimiocinas.
ABSTRACT
The mean of the study was to analyze the inflammatory and
anti-inflammatory response to an intense and intense swimming effort during the
preparatory phase for the Brazilian National Adult Championship. Twenty
swimmers participated. Plasma concentrations of IL-6, TNF-α, sTNFR1, IP-10
and MCP-1 were determined before and 40 minutes after 2 sets of 4 repetitions
of 50 meters swam at maximum intensity with 3 minutes of recovery between each
repetition and an active recovery swimming 1500m at low intensity after each of
the two series. In response to acute exercise only the sTNFR1 concentration was
reduced, with no changes in IP-10, IL-6 or TNF-α. Thus, acute exercise in
swimming in well-trained people does not seem to produce an inflammatory
response.
KEY WORDS: swimming,
citokynes, chemokines.
INTRODUCIÓN
El ejercicio ha sido prescrito tradicionalmente para mejorar la salud,
pero existen muchas evidencias que demuestran que el volumen y la intensidad del
entrenamiento son factores determinantes para que se produzcan efectos
positivos o negativos sobre la misma (WALSH y col., 2011b). El ejercicio
habitual de intensidad moderada, comúnmente se ha asociado con una reducción de
la susceptibilidad a las infecciones, pero también se ha descrito que el
ejercicio agudo intenso puede producir una disminución transitoria de la
inmunidad lo que facilitaría las infecciones oportunistas, fenómeno conocido
como “ventana inmunológica” (Walsh y col., 2011a; Gleeson
y Walsh, 2012).
El ejercicio agudo intenso puede ser inductor de daño muscular
produciendo liberación de citoquinas junto a otros factores tisulares locales
relacionados con el fenómeno inflamatorio (Smith, 2000). La familia de las
citoquinas es diversa, así como su función pudiendo ejercer un efecto
facilitador (proinflamatorias) o inhibidor
(antiinflamatorias) de la inflamación, así como un papel facilitador para la
producción de daño muscular (Smith, 2000; Robson,
2003; Ahima y Park, 2015; Allen, Sun
y Woods, 2015).
Tanto la propensión a las
infecciones como el daño muscular, se relacionan de forma más clara con
ejercicios de alto volumen, alta intensidad con períodos de descanso
insuficientes, un cuadro típicamente asociado con el síndrome de sobreentrenamiento.
El objetivo del presente estudio fue analizar la respuesta
inflamatoria a un esfuerzo agudo e intenso de natación, durante la fase previa
a los campeonatos nacionales de estos deportistas.
MATERIAL Y MÉTODOS
Participantes
La muestra estuvo constituida por 20 nadadores varones, que se
encontraban en una fase de entrenamiento preparatorio inmediato para el
campeonato brasileño absoluto, durante el que realizaban 10 sesiones semanales.
Todos tenían más de cinco años de experiencia en natación competitiva.
Procedimientos
del estudio
Todos firmaron el consentimiento voluntario para participar de la
investigación, requisito obligado por el Consejo Nacional de Salud (Brasil),
resolución nº 466/12, basadas en la declaración de Helsinki (1964 y resoluciones
posteriores). El proyecto fue aprobado por el Comité de Ética en Investigación
en Seres Humanos de la Universidad Federal de Minas Gerais / Brasil. Todos
tenían autorización médica para someterse al ejercicio propuesto.
El ejercicio agudo se realizó, tras una semana sin ninguna competición
y al día siguiente de un día de descanso, para evitar interferencias con los
datos analíticos. Tras un calentamiento de 1500 m de natación suave, se
realizaron 2 series de 4 repeticiones de 50 m (2x[4x50]) a la máxima
intensidad, con salida desde el poyete, con un descanso de 3 minutos entre cada
repetición, y entre cada serie realizaban un descanso activo consistente en un
nado suave de 1500 m. Después de las 2 series, hicieron 1500 m más de
recuperación.
Evaluación
de las citoquinas y de las quimiocinas
Inmediatamente antes del ejercicio y tras 40 min después de finalizado
el protocolo de ejercicio descrito, se realizó la extracción de 5 ml de sangre,
mediante venopunción de la vena antecubital.
Inmediatamente fue centrifugada a 2500 rpm, durante 15 min, y el sobrenadante
separado en partes alícuotas de 300μl
que fueron congeladas a -80ºC, hasta las determinaciones analíticas.
Las citoquinas y las quimiocinas fueron medidas mediante la técnica de análisis por inmunoabsorción
ligado a enzimas (ELISA), siguiendo los procedimientos del fabricante (R&D Systems, Minneapolis, MN). Las placas de poliestireno de 96 pocillos con 100 μl, fueron recubiertas con una
solución de anticuerpo de captura en una solución en agua destilada de
bicarbonato sódico (NaHCO3) con 8,4 mg/ml y cloruro de sodio (NaCl) con 5,8 mg/mL, a un pH de
9,6. Para cada placa se utilizó 10 ml de anticuerpo de captura, incubándose a
4º C durante 10 horas, y tras este periodo las placas fueron lavadas 4 veces
con tampón fosfato salino (PBS) 1X que contiene 0,1 % Tween
20 (PBS-T20). Se estabilizó posteriormente con 200 μl de solución de albúmina de suero bovino (BSA) 200 mg/placa al 0,1 %
y agua destilada durante 1 hora a temperatura ambiente; a continuación, se
colocaron las muestras en las placas para la reacción inmunoenzimática.
Posteriormente las placas fueron nuevamente lavadas 4 veces con los mismos
tipos de soluciones y se tomó 60 μL
de las muestras y diluidas 1:50 con solución tampón PBS 1X. Fueron colocados
500 μl de agua destilada en cada uno de los 6 microtubos.
En cada uno de los pocillos de la placa se colocó 100μl siendo los dos primeros el blanco con solamente PBS 1X. Fueron
colocadas en la placa de lectura las muestras en pares y se procedió a la
incubación durante 10 horas a 4°C; tras este periodo nuevamente fueron lavadas 4 veces con el mismo
tipo de soluciones que en los pasos previos. Se adicionaron 100μl de solución con el anticuerpo de detección en cada pocillo, salvo para
la citoquina IL-6 pues para su determinación fue adicionado 10μl de suero de carnero por placa ya que para el resto de las
determinaciones no es necesario. Las placas fueron cubiertas y colocadas en una
gradilla agitándose dos 2 horas a temperatura ambiente para la citoquina TNF-α y el receptor sTNFRI y una 1 hora para la
citoquina IL-6. A continuación tras lavar de nuevo 4 veces las placas con las
mismas soluciones, se adicionó 100μl
en cada pocillo de una solución de 2,5 μl de estreptavidina para cada 10ml de
diluyente y agitadas, durante 25 minutos. Nuevamente fueron lavadas las placas
4 veces con las mismas soluciones. A continuación, la reacción se detuvo
añadiendo 50 µl por pocillo de ácido sulfúrico (H2SO4) 1M. La lectura de
densidad óptica se efectuó en un lector de ELISA.
Análisis
Estadístico
El análisis estadístico se llevó a cabo utilizando el paquete
estadístico Graphic Prisma 4.0. La estadística
descriptiva se realizó con la media, la desviación estándar.
La verificación de la normalidad a través del Shapiro-Wilk
test para todas las variables. La significación estadística de las diferencias
existentes entre los distintos parámetros estudiados que presentaron
distribución normal se realizó mediante el Test T, estableciéndose un nivel de
significación de p<0,05.
RESULTADOS
En la Tabla 1 se recogen los datos descriptivos de la edad, masa
corporal y de la de talla de los sujetos del estudio.
Tabla 1. Características generales de los nadadores
|
|
media ±
desviación estándar |
|||
|
Edad |
(años) |
18,7 |
± |
1,1 |
|
Masa Corporal |
(kg) |
72,4 |
± |
4,0 |
|
Talla |
(cm) |
179,0 |
± |
7,0 |
En la tabla 2 se recogen los
resultados de las determinaciones de las citoquinas y de las quimioquinas. Se puede
observar que en respuesta al ejercicio agudo no se produjeron cambios
significativos en la IL-6,
TGN-a, MCP-1 ni tampoco en la IP-20, pero sí se observó una disminución en los
niveles de sTNFR1.
Tabla 2. Valores de las quimioquinas y citoquinas
determinadas.
|
|
Antes |
Después |
p valor |
||||
|
IL-6 (pg/mL) |
4,3 |
± |
3,7 |
4,5 |
± |
5 |
0,949 |
|
TNF-a (pg/mL) |
230,4 |
± |
299,5 |
241,5 |
± |
416,9 |
0,925 |
|
sTNFR1 (pg/mL) |
143,2 |
± |
34,7 |
83,4 |
± |
31,6 |
0,000 |
|
MCP-1 (pg/mL) |
9,2 |
± |
12,9 |
7,759 |
± |
12,64 |
0,722 |
|
IP-10 (pg/mL) |
909,4 |
± |
618,2 |
956,8 |
± |
700,6 |
0,826 |
(media
±
desviación estándar)
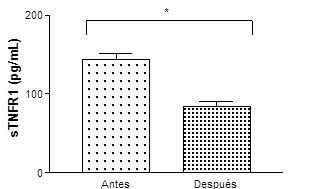
Gráfica 1: Concentración de la inhibidora de citoquina sTNFR1 de los nadadores
Estadísticamente diferente entre las tomas (*)
DISCUSIÓN
La respuesta inflamatoria en nuestro estudio fue evaluada en respuesta
a un esfuerzo intenso agudo. Nos hemos centrado en la respuesta de las
citoquinas y quimioquinas al ejercicio agudo, aún a sabiendas de la dificultad
que representa la interpretación de las determinaciones de parámetros relativos
al sistema inmune por ser un sistema complejo en el que participan además
factores celulares, hormonales. No obstante, es interesante su estudio pues ese
sistema se ve afectado por el ejercicio agudo de forma importante en función de
la intensidad y la duración del mismo (Walsh y col., 2011b).
En nuestro estudio la respuesta de la citoquina proinflamatoria TNF-α al ejercicio agudo de natación no muestra cambios, a diferencia del
estudio de Nemet y col., (2003) que sí encuentra una reducción. En nuestro
estudio los niveles de IL-6 tampoco cambiaron probablemente porque como señala
Pedersen y col., (2003), TNF-α,
IL-6 y citoquinas están muy relacionadas
y una de las funciones de la TNF-α
es la estimulación de la producción de IL-6 durante el ejercicio y a su vez la
IL-6 producida durante el ejercicio probablemente inhiba el efecto que la TNF-α ejerce facilitando la resistencia de la insulina en los tejidos
periféricos (Pedersen y col., 2003). Resultados semejantes a los nuestros han
sido también descritos en el estudio de Morgado y col., (2012), en el que no
encontraron cambios en las respuestas inflamatorias.
Otra de las razones posibles de que no se produjeran modificaciones en
la concentración IL-6 en respuesta al ejercicio en nuestros nadadores
experimentados, quizá sea debido como sugieren Morgado y col., (2012), a la
protección antiinflamatoria que el ejercicio crónico tiende a producir,
protegiendo ante el estrés fisiológico provocado por el ejercicio. Se ha
descrito que la IL-6 facilita el mantenimiento de la homeostasis metabólica de
los hidratos de carbono y de los lípidos, durante el ejercicio de larga
duración (Pedersen y col., 2003), tal vez se pudiera suponer que la no
variación de la IL-6 en respuesta al ejercicio realizado en este estudio
pudiera deberse en parte a que nuestro protocolo de esfuerzo agudo no produjo
una reducción importante de los niveles del glucógeno muscular.
En el estudio de Morici y col., (2005) en el que realizaban esfuerzo
supramáximo, los niveles de IL-6 tampoco aumentaron inmediatamente, ni tampoco
lo hizo en el estudio de Li y Gleeson (2005), si bien en este último estudio sí
que hubo un incremento significativo cuatro días después de realizado el
ejercicio agudo. Se podría esperar un efecto acumulativo de los niveles de la
IL-6 como consecuencia trabajo desarrollado a lo largo de los días, pero
nuestro estudio se realizó tras un día de descanso después de una semana de
entrenamiento de mucho volumen pero de poca intensidad.
En los sujetos de nuestro estudio los niveles basales de las
citoquinas proinflamatorias IL-1β
y TNF-α fueron bajos, lo que pudiera ser debido a los efectos inhibidores de
otras citoquinas de corta vida media y además estos bajos niveles de estas dos
citoquinas contribuirían a prevenir una gran activación de la inflamación
sistémica como sugiere Nieman y col., (2001). Por último, la ausencia de
respuesta de estas citoquinas al ejercicio propuesto en nuestro es estudio, se
deba a que para que se produzca una respuesta proinflamatoria, según Suzuki y
col., (2006), es necesario un gran daño
muscular al igual que para el incremento de la IL-1β, no habiéndose producido em nuestros deportistas un daño muscular
aparente. En algunos estudios como en el de Harnish y Sabo (2016), encontraron
una elevación del TNF-α
después del ejercicio, manteniéndose elevada durante las 24 horas siguientes al
ejercicio.
En nuestro estudio la respuesta de la sTNFR1 al ejercicio consistió en
una redución significativa. Nuestros resultados no son como los reflejados en
la literatura, Pussieldi y col., (2014), tras la realización de un ejercicio
agudo en bicicleta de montaña en el que se encontraron un aumento de la
respuesta antiinflamatoria y de esta citoquina en particular.
El sTNFR1, que se une al TNF-α,
tiene una vida media más duradera que al TNF-α en la circulación, como fue descrito en el estudio de Pussieldi y
col. (2014), que encontró un retorno a los niveles basales de esta citoquina tras
24h de haber finalizado el ejercicio, en los nadadores, el sTNFR1 presentó una
disminución después de 40 minutos de finalizado el esfuerzo, a pesar de haber
realizado el ejercicio a alta.
En respuesta al ejercicio tampoco hubo modificación de los niveles
plasmáticos de MCP-1, de forma semejante a lo que se observa con los niveles de
la IP-10. A pesar de que la intensidad a la se hacen las pruebas de natación es
máxima, pues los atletas buscan alcanzar sus mejores tiempos, pero no se han
encontrado aumentos de la quimiocina MCP-1 como cabría esperar. Por eso se ha
sugerido que los niveles de la MCP-1 no se modifican tras un ejercicio máximo
de natación debido por una parte a la duración del esfuerzo y sobretodo a la
ausencia de impacto mecánico con un claro predominio del componente concéntrico
en las acciones musculares en este deporte y por lo tanto el daño muscular
sería pequeño, y como hemos indicado se sabe que el daño muscular se correlaciona con aumento de la respuesta
inflamatoria sistémica (Pyne y Gleeson, 1998 ;
Fehrenbach y Schneider, 2006). En el estudio de Willoughby y col.
(2003), en el que se estudiaron los efectos de las contracciones excéntricas y
concéntricas en la función muscular y la respuesta inflamatoria después del
ejercicio, encontraron que las contracciones excéntricas inducen más daño
muscular de que las concéntricas y más altos incrementos en los niveles de
IL-6.
Las concentraciones plasmáticas de la quimioquina IP-10 no
experimentaron cambios en respuesta al ejercicio agudo en los nadadores,
probablemente por un bajo acúmulo del cansancio durante los entrenamientos
previos dado que Walsh y col. (2011) sugieren que la intensidad del ejercicio
es un factor importante para la respuesta del sistema inmune al ejercicio, así
los ejercicios intensos parecen tener un efecto acumulativo en la respuesta
inmunitaria. Por otra parte, no es clara la respuesta de la quimiocina IP-10 al
ejercicio agudo en los datos reflejados en la literatura, lo que añade mayor
dificultad a la hora de comparar nuestros datos. En el estudio de Deyhle y col.
(2016) observaron un aumento significativo de IP-10, después de una serie de
ejercicios excéntricos máximos, a diferencia de lo encontrado en nuestro
estudio.
En nuestro estudio no parece existir un aumento de la actividad
antiinflamatoria pues no hemos encontrado incremento de las citoquinas
proinflamatorias, a pesar de que disminuye la concentración de la citoquina
inhibidora, sTNFR-1, al igual que Fischer y col. (2004) que encontraron que
después de un período de entrenamiento de diez semanas, las adaptaciones se
reflejaron en una reducción de los niveles de citoquinas inflamatorias como
respuesta al ejercicio agudo. De igual manera King y col. (2003) también
encontraron una significante disminución de la respuesta de los marcadores
inflamatorios en los participantes de algunas modalidades, incluyendo natación,
pero los resultados de ellos no son concluyentes ya que no fueron controladas
ni la duración ni la intensidad del esfuerzo.
CONCLUSIONES
En deportistas entrenados, el ejercicio agudo de natación no produce
una respuesta inflamatoria generalizada ni daño muscular significativo, ni
compromete la respuesta inmunitaria.
REFERENCIAS BIBLIOGRÁFICAS
Ahima RS, Park HK. Connecting Myokines and Metabolism.
Endocrinol Metab (Seoul). 2015 Sep;30(3):235-45. https://doi.org/:
10.3803/EnM.2015.30.3.235. Epub 2015 Aug 4.
Allen J, Sun Y, Woods JA. Exercise and the regulation
of inflammatory responses. Prog Mol Biol Transl Sci. 2015;135:337-54. https://doi.org/:
10.1016/bs.pmbts.2015.07.003. Epub 2015 Jul 31.
Deyhle MR, Gier AM, Evans KC, Eggett DL, Nelson WB,
Parcell AC, Hyldahl RD. Skeletal muscle inflammation following repeated bouts
of lengthening contractions in humans. Front Physiol.2016 Jan 12;6:424.
https://doi.org/: 10.3389/fphys.2015.00424.
Fehrenbach E, Schneider ME. Trauma-induced systemic
inflammatory response versus exercise-induced immunomodulatory effects. Sports
Med 2006;36(5):373-384.
Fischer CP, Plomgaard P, Hansen AK, Pilegaard H, Saltin
B, Pedersen BK. Endurance training reduces the contraction-induced
interleukin-6 mRNA expression in human skeletal muscle. Am J Physiol Endocrinol
Metab 2004; 287: E1189-E1194.
Gleeson M, Walsh NP. The BASES expert statement on
exercise, immunity, and infection. J Sports Sci. 2012; 30(3): 321-324.
https://doi.org/: 10.1080/02640414.2011.627371
Harnish CR, Sabo RT. Comparison of two different
sprint interval training work-to-rest ratios on acute inflammatory responses.
Sports Med. 2016; 2:20. https://doi.org/ 10.1186/s40798-016-0044-1
King DE, Carek P, Maionous AG, Pearson WS.
Inflammatory markers and exercise: differences related to exercise type. Med
Sci Sports Exerc 2003;35(4):575-581.
Li T-L, Gleeson M. The effects of carbohydrate
supplementation during the second of two prolonged cycling bouts on
immunoendocrine responses. Eur J Appl Physiol 2005;95(5-6):391-399.
Morgado JM, Rama L, Silva I, Inácio MJ, Henriques A,
Laranjeira P, Pedreiro S,·Rosado F, Alves F, Gleeson M, Pais ML, Paiva A,
Teixeira AM. Cytokine production by monocytes, neutrophils, and dendritic cells
is hampered by long-term intensive training in elite swimmers. Eur J Appl Physiol
2012; 112(2):471-482. https://doi.org/ 10.1007/s00421-011-1966-4 123
Morici G, Zangla
D, Santoro A, Pelosi E, Petrucci
E, Goia M, Bonanno A, Profita M, Bellia V, Testa U, Bonsignore MR. Supramaximal
exercise mobilizes hematopoietic progenitors and reticulocytes in athletes. Am
J Physiol Regulatory Integrative Comp Physiol 2005;289(5):R1496-R1503.
Nemet D, Rose-Gottron CM, Mills P.J, Cooper DM.
Effect of water polo practice on cytokines, growth mediators, and leukocytes in
girls. Med Sci Sports Exerc 2003;35(2):356-363.
Nieman DC, Henson DA, Smith LL, Utter AC, Vinci DM,
Davis JM,Kaminsky DE,
Shute M. Cytokine changes after a marathon race. J Appl Physiol
2001;91(1):109-114.
Pedersen BK, Steensberg A, Keller P, Keller C,
Fischer C, Hiscock N, Van Hall G, Plomgaard P, Febbraio MA. Muscle-derived
interleukin-6:lipolytic,anti-inflammatory and immune regulatory effects. Pflugers Arch
2003;446:9-16.
Pussieldi GA, Gomes EC, Veneroso CE, De
Paz Fernández JA, Rossi AG, Teixeira MM, Teixeira
AL.; Alessandri AL. Soluble tumour
necrosis factor receptor-1 (sTNFR1) levels are positively associated with
exercise intensity in athletes after strenuous off-road cycling. J Sports Med
Phys Fitness (Testo stampato). 2014; 54:225-231.
Pyne DB, Gleeson M. Effects of intensive exercise
training on immunity in athletes. Int J Sports Med 1998;19(Suppl
3):S183-S191;discussion S191-S194.
Robson PJ. Elucidating the unexplained
underperformance syndrome in endurance athletes: the interleukin-6 hypothesis.
Sports Med 2003;33(10):771-781.
Smith LL. Cytokine hypothesis of overtraining: a
physiological adaptation to excessive stress? Med Sci Sports Exerc
2000;32(2):317-331.
Suzuki K, Peake J, Nosaka K, Okutsu M, Abbis CR,
Surriano R, Bishop D, Quod MJ, Lee H, Martin DT, Laursen PB. Changes in markers
of muscle damage, inflammation and HSP70 after an Ironman triathlon race. Eur J
Appl Physiol 2006;98(6):525-534.
Walsh NP, Gleeson M, Shephard RJ, Gleeson M, Woods
JA, Bishop NC, Fleshner M, Green C, Pedersen BK, Hoffman-Goetz L, Rogers CJ,
Northoff H, Abbasi A, Simon P. Position statement. Part one: Immune function
and exercise. Exerc Immunol Rev. 2011a, 17:6-63.
Walsh NP, Gleeson M, Pyne DB, Nieman DC, Dhabhar FS,
Shephard RJ, Oliver SJ, Bermon S, Kajeniene A. (b) Position statement. Part
two: Maintaining immune health. Exerc Immunol Rev. 2011b;17:64-103.
Willoughby DS, Vanenk C, Taylor L. Effects of
concentric and eccentric contractions on exercise-induced muscle injury,
inflammation, and serum IL-6. JEPonline 2003;6(4):8-15.
Referencias totales / Total references:22 (100%)
Referencias propias de
la revista / Journal's own references: 0 (0%)
Rev.int.med.cienc.act.fís.deporte
- vol. 18 - número 71 - ISSN: 1577-0354