 Güereca-Arvizuo, J.;
Ramos-Jiménez, A.; Moreno-Brito, V.; Cervantes-Borunda, M.; Hernández-Torres, R.P.
(2020)
Response of Creatine Kinase to an Anaerobic Supramaximal Exercise in ACTN3
Genotypes. Revista Internacional
de Medicina y Ciencias de la Actividad Física y el Deporte vol. 20 (79) pp. 381-393 Http://cdeporte.rediris.es/revista/revista79/artefecto1172.htm
Güereca-Arvizuo, J.;
Ramos-Jiménez, A.; Moreno-Brito, V.; Cervantes-Borunda, M.; Hernández-Torres, R.P.
(2020)
Response of Creatine Kinase to an Anaerobic Supramaximal Exercise in ACTN3
Genotypes. Revista Internacional
de Medicina y Ciencias de la Actividad Física y el Deporte vol. 20 (79) pp. 381-393 Http://cdeporte.rediris.es/revista/revista79/artefecto1172.htm
DOI: http://doi.org/10.15366/rimcafd2020.79.001
ORIGINAL
RESPUESTA DE
CREATINA QUINASA A UN EJERCICIO ANAEROBIO SUPRAMÁXIMO EN GENOTIPOS DE ACTN3
RESPONSE OF CREATINE KINASE TO AN ANAEROBIC
SUPRAMAXIMAL EXERCISE IN ACTN3 GENOTYPES
Güereca-Arvizuo,
J.1; Ramos-Jiménez, A.2; Moreno-Brito, V.3;
Cervantes-Borunda, M.4 y Hernández-Torres, R.P.4
1 Docente e investigador.
Departamento de Ciencias de la Salud, División Multidisciplinaria en Ciudad
Universitaria. Universidad Autónoma de Ciudad Juárez (México) jaime.guereca@uacj.mx
2 Docente e
investigador. Departamento de Ciencias de la Salud, Instituto de Ciencias
Biomédicas. Universidad Autónoma de Ciudad Juárez (México) aramos@uacj.mx
3 Docente e
investigador. Facultad de Medicina y Ciencias Biomédicas. Universidad Autónoma
de Chihuahua (México) vmoreno@uach.mx
4 Docentes e investigadores.
Facultad de Ciencias de la Cultura Física. Universidad Autónoma de Chihuahua
(México) mcervant@uach.mx,
rhernant@uach.mx
AGRADECIMIENTOS: Los autores agradecen al Consejo Nacional de Ciencia
y Tecnología (CONACYT) por la beca doctoral de Jaime Güereca Arvizuo
(371390/249892).
Código UNESCO/UNESCO Code: 2409 Genética / Genetics; 5899
Deportes / Sports
Clasificación del Consejo de
Europa/Council of Europe Classification: 2. Bioquímica del deporte / Biochemistry of sport
Recibido 28 de agosto de 2018. Received August 28, 2018
Aceptado 2 de febrero de 2019. Accepted February 2, 2019
RESUMEN
El
objetivo del presente estudio fue investigar las diferencias en la actividad de
la enzima Creatina Quinasa (CK) en pre y post ejercicio anaerobio supramáximo
(EASM) en portadores de los genotipos del gen de la alfa-actinina-3 (ACTN3). Se reclutaron 39 hombres sanos
físicamente activos (18-35 años) y se sometieron a un EASM de 30 s (Wingate).
El gen ACTN3 se determinó a partir
del ADN de glóbulos blancos en sangre periférica y se evaluó la actividad de la
CK en muestras sanguíneas en condiciones basales, a las 24 y 48 h post EASM.
Los portadores del genotipo XX vs RR
presentaron 1,4 veces menor actividad de CK en condiciones basales (p<0,05) y una mayor actividad de CK a
las 24 h post ejercicio (p<0,05).
Una serie de EASM fue capaz de causar un incremento significativo de la
actividad de CK a las 24 h en los portadores del genotipo XX.
PALABRAS CLAVE: Alfa-actinina-3, creatina quinasa, genética deportiva, polimorfismo
genético.
ABSTRACT
The aim of the present study was
to investigate the differences in the activity of the enzyme Creatine Kinase
(CK) in pre and post anaerobic supramaximal exercise (ASME) on carriers of the genotypes of the
alpha-actinin-3 gene (ACTN3). 39
healthy physically active men (18-35 years) were enrolled and underwent an ASME
of 30 s (Wingate). The ACTN3 gene was
determined from the DNA of white blood cells in peripheral blood and the CK
activity was evaluated in blood samples in basal conditions, at 24 and 48 h
after of ASME. The carriers of genotype XX vs
RR had 1.4 times lower CK activity in basal conditions (p<0.05) and higher CK activity at 24 h after exercise (p<0.05). A series of ASME was capable
of causing a significant increase in CK activity at 24 h in the XX genotype
carriers.
KEYWORDS: Alpha-actinin-3, creatine kinase, gene polymorphism, sports genetics.
INTRODUCCIÓN
El
estudio de la genética en fechas actuales ha permitido conocer que la expresión
de ciertos genes beneficia las capacidades físicas. No obstante, las
capacidades físicas no están determinadas por un solo gen, sino por la sinergia
e interacción de varios genes y la respuesta de estos a las condiciones
ambientales (Saunders et al., 2007). A la fecha, se han estimado
aproximadamente más de 200 variaciones genéticas relacionadas al rendimiento
deportivo (Bray et al., 2009) pero, sólo
poco más de 20 polimorfismos están estrechamente relacionados con el deportista
de alto rendimiento (Bray et al.,
2009). El polimorfismo R577X del gen de la alfa-actinina-3 (ACTN3), es uno de los polimorfismos más
estudiados en el ámbito del desempeño deportivo y de las capacidades físicas.
El gen ACTN3 presenta dos alelos, el alelo R
codifica para la proteína funcional alfa-actinina-3 y del alelo X se obtiene
una proteína alfa-actinina-3 no funcional (MacArthur y North, 2004). La
proteína alfa-actinina-3 se expresa sólo en músculo esquelético, específicamente
en las fibras de contracción rápida (Beggs et al., 1992), y es una de las
principales componentes estructurales de la línea Z del sarcómero (Beggs et
al., 1992). La combinación de los alelos R y X da origen a los genotipos RR, RX
y XX. Estos genotipos, han sido asociados con el rendimiento deportivo habiendo
indicios de que proporcionan ventaja deportiva, ya sea de tipo aeróbica o
anaeróbica (MacArthur y North, 2004). Dicho de otra manera, los genotipos RR y
RX se asocian con una mayor capacidad de desarrollar
potencia (Orysiak
et al., 2014), fuerza (Broos et al., 2015) y velocidad (Mikami et al., 2014). Mientras que el genotipo XX
favorece las actividades de resistencia aeróbica (Yang et al., 2003).
Se ha
reportado que la proteína ACTN3 tiene
funciones de señalización metabólica en el músculo esquelético, al menos en
modelo murino (Lee, Houweling, North y Quinlan, 2016), y por
ello favorecer la fuerza muscular (MacArthur et al., 2008). Sin embargo, también
se conoce que la ausencia de esta proteína (genotipo XX) no perjudica la
contracción muscular (Zanoteli et al., 2002), pero provoca cambios a nivel enzimático en músculo esquelético de
ratón KO, modificando el metabolismo de las fibras rápidas, volviéndolas
más oxidativas (MacArthur et al., 2008). Se reporta
además una disminución en las propiedades elásticas de las proteínas musculares
a nivel de la línea Z del sarcómero (Seto et al., 2011), lo que se reflejaría
en una menor capacidad de generar contracciones fuertes y rápidas. Con lo anterior
podemos deducir que los portadores del genotipo XX serían más susceptibles al
daño muscular provocado por contracciones fuertes y rápidas (Clarkson
et al., 2005; Vincent et al., 2010) lo cual se
vería reflejado en un incremento en la actividad de la Creatina Quinasa (CK).
Por
otro lado, recientemente, se han reportado resultados inconsistentes en la
actividad enzimática de la CK post ejercicio entre genotipos de ACTN3 (Clarkson et al., 2005; Vincent et
al., 2010; Venckunas et al., 2012). En
el ambiente deportivo, la CK,
es utilizada como marcador bioquímico de daño tisular (Landau et al., 2012; Wu et al., 2004), sus concentraciones en plasma se
incrementan posterior al ejercicio aeróbico (Hoffman,
Ingwerson, Rogers, Hew-Butler y Stuempfle, 2012) o anaeróbico (Rodas et al.,
2002; Vincent et al., 2010), siendo suficiente una sola sesión de ejercicio
anaerobio supramáximo (EASM) para verla aumentada (Hammouda et al., 2012). Por lo anterior, el objetivo del presente trabajo fue investigar las
diferencias en la actividad de la enzima CK pre y post EASM (Wingate) entre
genotipos de ACTN3 en participantes
físicamente activos.
MATERIALES Y MÉTODOS
Participantes
En un
estudio transversal-observacional se reclutaron a 42 hombres sanos físicamente
activos (edad 18-35 años) que realizaban actividades deportivas tres o más días
a la semana. Los criterios de inclusión fueron: hombres saludables y
físicamente activos. Los de exclusión: atletas de alto rendimiento, deportistas
y participantes que estuvieran bajo algún tratamiento médico farmacológico, o
que presentaran alguna lesión muscular que les impidiera realizar ejercicio
físico. Antes de los estudios, a cada uno de los participantes se les explicaron
los procedimientos y riesgos propios de las evaluaciones del estudio,
posteriormente firmaron la carta de consentimiento informado. Para asegurarse
del buen estado de salud de los participantes se les aplicó un cuestionario de
salud general y el cuestionario PAR-Q & YOU (Thomas et al., 1992). El
protocolo de investigación y sus procedimientos fueron aprobados por el comité
de ética de la Universidad Autónoma de Ciudad Juárez (CBE.ICB/053.08-15),
basados en las recomendaciones de la declaración de Helsinki.
Todas
las mediciones y determinaciones se realizaron de 8 a 10 h, pidiendo a los
participantes presentarse al laboratorio en condiciones de ayuno de al menos 8
h, y sin haber practicado ejercicio y/o actividad física intensa durante 3 días
previo al estudio.
Ejercicio anaerobio supramáximo
Antes de la
aplicación del EASM se pesó al sujeto en traje de baño con una báscula digital
(SECA 876,
Hamburgo, Alemania). Posteriormente se aplicó un calentamiento general de
10 min incluyendo 5 min en bicicleta, para luego aplicarle el test anaeróbico
de Wingate como EASM (Monark Ergomedic 884e, Suecia), de acuerdo con los
procedimientos ya publicados (Bar-Or, 1987). La carga aplicada al
cicloergómetro durante el test fue el 7,5% del peso corporal del participante.
Determinación de la actividad
enzimática de la CK
Para determinar la cinética de la CK en plasma se
pidió al participante presentarse durante 3 días consecutivos, en los cuales, a
través de una punción en la vena antecubital, se obtuvo una muestra sanguínea
antes de la aplicación del EASM, a las 24 y 48 h post EASM. La concentración de
CK se determinó a través de un analizador de química clínica (Cobas Integra 400
plus, Roche Instrument Center, USA).
Genotipos
A través de un kit comercial MasterPure (Epicentre
Biotechnolgies, USA) se obtuvo ADN genómico de leucocitos. Se
amplificó un segmento de 291 pares de bases (pb) del gen ACTN3 aplicando la técnica de reacción en cadena de la polimerasa
(PCR), se utilizaron los siguientes cebadores: directo: 5´-CTGTTGCC TGTGGTAAGTGGG-3’
y reverso: 5´-GGTCACAGTATGCAGGAGGG-3’ (Eurofins MWG-Operon, Alemania). La
reacción de la PCR se realizó mezclando: 19 µL de agua estéril, 2,5 µL de buffer, 0,75 µL de MgCl2,
0,5 µL de dNTP’s, 0,5 µL del cebador directo/reverso, una muestra de ADN a 100
ng y 0,25 µL de la enzima Taq
polimerasa, todo lo anterior sometido a 35 ciclos bajo las siguientes condiciones de amplificado: desnaturalización inicial de 95°C
durante 10 min y de 95°C durante 1 min para la segunda desnaturalización. Para
la etapa de alineación fue de 58°C durante 30 s y la etapa de elongación de
72°C durante 1 min, una etapa de finalización a 72°C durante 10 min. Para la
determinación de los genotipos de ACTN3,
se combinó el amplificado de PCR y la enzima DdeI (Desulfovibrio
desulfuricans) (New England BioLabs, Estados Unidos) y se incubó a 37°C en
calor húmedo durante 4 h y 20 min de inactivación a 65°C. Se visualizaron los
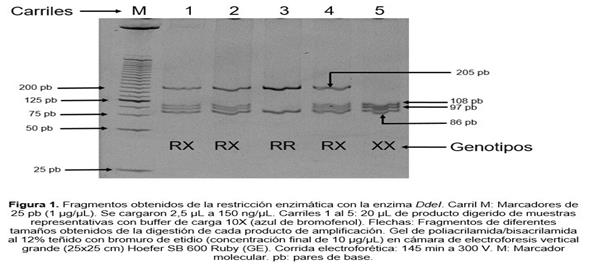
productos en geles de poliacrilamida al 12%. Para el genotipo RR se obtuvo las
siguientes bandas: 205 y 86 pb, mientras que para el genotipo RX: 205, 108, 97 y
86 bp, por último, para el genotipo XX: 108, 97 y 86 pb (Figura 1)
Mediciones antropométricas, somatotipo y composición corporal
Todas
estas mediciones se realizaron de acuerdo con el protocolo ya publicado
(Güereca et al., 2017) y siguiendo la metodología estandarizada por la
International Society for the Advancement of Kinanthropometry (ISAK). Para
determinar los componentes del somatotipo (Heath y Carter, 1990) y composición
corporal se utilizó el software LifeSize 2,0 (Sidney, Australia) (Olds y
Norton, 2000).
Análisis estadísticos
Para
conocer las diferencias en las frecuencias genotípicas se realizó una Chi
cuadrada (c2) para el total de la población (42 participantes). Sin embargo,
3 participantes no completaron la totalidad de las mediciones y fueron eliminados
del estudio. El tamaño de la muestra se calculó con el programa G*power 3,1,9,2
(Faul, Erdfelder, Lang y Buchner, 2007), usando un tamaño del efecto de 0,50, un
valor de alfa de 0,05 y un poder de 0,80, sugiriendo una muestra total de 9 participantes
por grupo. Para comprobar la normalidad de los datos se
aplicó el test de Shapiro-Wilk, y se buscaron valores atípicos utilizando el
diagrama de cajas y bigotes. En la búsqueda de diferencias entre genotipos,
características antropométricas y actividad de CK, se aplicó un análisis de
varianza (ANOVA) multivariante y la prueba post
hoc de Tukey. Para analizar las diferencias en la actividad de la CK entre
genotipos, entre tiempo y la posible influencia de la edad y masa muscular, se
aplicó un ANOVA de medidas repetidas, colocando al genotipo como factor
inter-sujetos, la edad y la masa muscular como covariable, seleccionándose el
método Bonferroni para comparar los efectos principales. Por último, para
eliminar la posible influencia de los valores basales en CK se realizó un ANOVA
univariante de los residuales (24 y 48 h menos las concentraciones basales). El
nivel de significancia estadística fue del 0,05. Los datos se analizaron con el
programa SPSS versión 22,0.
RESULTADOS
Las
frecuencias alélicas y genotípicas se presentan en la Tabla 1, observándose que
la muestra poblacional se encuentra en equilibrio Hardy-Weinberg (X2 = 0,095; p = 0,75).

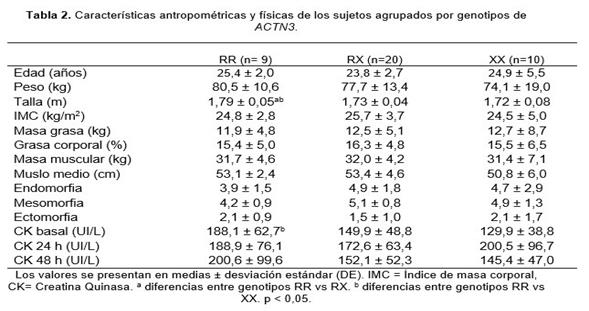
Las características físicas de los participantes entre genotipos fueron
semejantes, excepto en la estatura (tabla 2), donde los participantes con
genotipo RR fueron más altos que sus contrapartes. Los resultados de la
actividad de CK se presentan al final de la Tabla 2.
Los resultados
de los fragmentos obtenidos de la restricción enzimática con la enzima DdeI para la determinación de los
genotipos de ACTN3, se muestran en la
Figura 1.
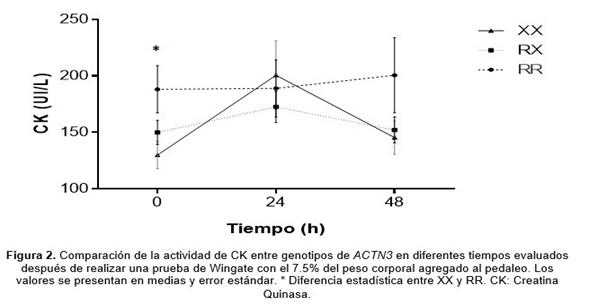
Al analizar de manera individual las concentraciones iniciales
(tiempo 0) de CK entre genotipos, se observó una menor concentración en el
genotipo XX vs RR (Figuras 2 y 3). Al
analizar de manera simultánea por medidas repetidas las diferencias en CK entre
genotipo y tiempo, sólo se observaron diferencias entre tiempo, siendo mayor
las concentraciones de CK a las 24 h respecto a los valores basales (p = 0,012); sin embargo, a través del análisis univariante
de los residuales se observó que sólo en el genotipo XX vs RR la CK se elevó y presentó diferencias estadísticas a las 24 h
post EASM (Figura 3).
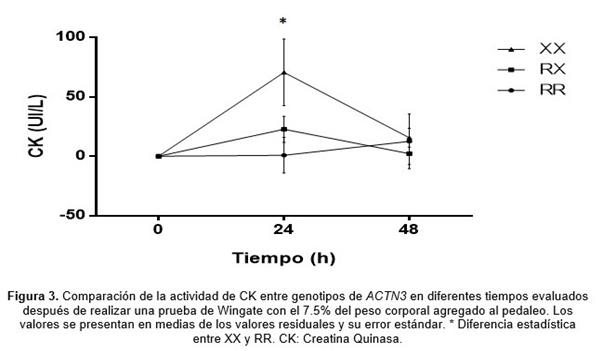
DISCUSIÓN
Al
eliminar la posible influencia de las condiciones basales de la actividad de CK
por medio del análisis de los residuales, se observó que los portadores del
genotipo XX vs RR presentan una mayor
actividad a las 24 h post EASM, regresando a sus valores basales a las 48 h (p <0,05). Dichos resultados son
similares a los reportados previamente por Vincent et al. (2010), quienes
reportaron una tendencia no significativa, a las 24 h post ejercicio excéntrico.
Lo anterior
nos sugiere que los portadores del genotipo XX vs RR podrían ser más susceptibles a sufrir daño muscular después
de una serie de EASM. Los presentes resultados están acordes a lo hipotetizado,
pues se esperaba que los portadores de los genotipos XX vs RR presentarían una mayor actividad de la enzima CK post
ejercicio. Se ha descrito que la actividad de CK en personas no entrenadas es
mayor post ejercicio (Vincent y Vincent, 1997), sin embargo, en este trabajo no
encontramos diferencias en las
características físicas de los sujetos que pudieran influir en la actividad de
CK. Se ha encontrado también que, en ratones, los portadores del genotipo XX presentan
una disminución en las propiedades elásticas de las proteínas musculares a
nivel de la línea Z del sarcómero (Seto et al., 2011), provocando una
disminución en las interacciones con otras proteínas musculares (Seto et al.,
2011), lo que los haría más susceptibles al daño muscular durante el ejercicio
(Clarkson et al., 2005). Por otro lado, se presume que la presencia del alelo R
juega un papel de protección contra el daño muscular ante el incremento del
ejercicio (Vincent et al., 2010)
Dado a las bajas concentraciones de CK
encontradas a las 24 y 48 h post EASM (< 500 UI/L), se
considera que el ejercicio aplicado no fue de intensidad suficiente para
provocar daño muscular (Martínez-Abat et al., 2005). Los resultados más altos
de CK post ejercicio fueron de 200,5 UI/L en el genotipo XX, datos cercanos a los
valores basales encontrados por otros autores (166-177 UI/L; Schumann
y Klauke, 2003). Por lo anterior, una posible limitación del estudio fue no
detectar el mejor momento para determinar la máxima actividad de la CK; sin
embargo, hay contradicciones con relación al tiempo de
detección del pico máximo de CK post ejercicio. Por ejemplo, en el trabajo de
Pimenta et al. (2012) reportan la mayor actividad de CK a las 4 h post
ejercicio, por el contrario, otros estudios mencionan que la mayor actividad se
encuentra entre las 24 y 48 h post ejercicio (Vincent et al., 2010; Venckunas
et al., 2012).
Por otro lado, el presente estudio muestra que los portadores del genotipo XX vs RR presentan menor actividad de CK en
condiciones basales (1,4 veces menos), datos similares a los reportados por
Clarkson et al. (2005). La menor actividad de CK observada en los portadores del
genotipo XX podría ser debido al tipo de fibra muscular. Se ha reportado que los
portadores del genotipo XX vs RR y RX
presentan mayor proporción de fibras tipo I (Ahmetov et al., 2011), mientras que los portadores del genotipo RR vs XX, presentan mayor proporción de
fibras musculares IIx (Vincent et al., 2010) y una mayor área seccional
transversal en las fibras IIa y IIx (Broos et al., 2016) siendo las fibras tipo
II las que contienen una mayor concentración de CK (Jansson, y Sylvén, 1985) debido a su metabolismo energético.
Se ha
observado que la actividad de la CK se modifica por la edad, el género, la raza
y la masa muscular (Baird, Graham, Baker, y Bickerstaff, 2012; Meltzer, 1971).
Para determinar la posible influencia de la edad y la masa muscular sobre la
actividad de la CK, se incluyeron como covariables en el modelo estadístico,
sin embargo, no se observó la participación de ninguna de ellas.
Los
estudios donde se relaciona la actividad de la CK y los genotipos de ACTN3 son escasos (Clarkson et al., 2005;
Vincent et al., 2010; Venckunas et al., 2012), una de las principales diferencias entre dichos estudios y el presente
trabajo, son los protocolos de ejercicio empleados para la estimulación de la
CK. En el presente estudio se aplicó una sola sesión de EASM, mientras que
Vincent et al. (2010) emplearon 20 repeticiones de
contracciones excéntricas máximas de rodilla, Clarkson et
al. (2005) emplearon 50 repeticiones de contracciones excéntricas máximas en flexores de codo, y Venckunas et al. (2012) emplearon 2 series de 50
saltos verticales. Dichos protocolos se basan en movimientos poco frecuentes
durante la práctica de algún deporte de alto rendimiento, no obstante, y a
pesar de utilizar protocolos anaeróbicos de ejercicio diferentes, ninguno de ellos
estimuló incrementos significativos en la actividad de CK entre los genotipos.
Debido
a que la prueba de Wingate aquí aplicada detectó poco incremento, pero
significativo de CK a las 24 h post ejercicio, y solo en los portadores del
genotipo XX, se sugiere un muestreo de la actividad de CK con
intervalos más cortos entre las 4 y 24 h post EASM, además un protocolo de
ejercicio más intenso y de mayor tiempo, ya que se ha
observado que cuando el ejercicio es de mayor duración, las concentraciones de
CK en plasma son mucho mayores (Belli et al., 2017;
Del Coso et al., 2017).
CONCLUSIONES
El
presente estudio muestra que los portadores del genotipo XX vs RR presentan menor actividad de CK en
condiciones basales y una mayor actividad a las 24 h post EASM. Sin embargo, la
intensidad, el tiempo y tipo de ejercicio aplicado no fueron suficientes para
estimular una elevación de la CK superior a las 500 UI/L, nivel sugerido como
indicador de daño muscular.
REFERENCIAS
BILIOGRÁFICAS
Ahmetov, I.I.,
Druzhevskaya, A.M., Lyubaeva, E.V., Popov, D.V., Vinogradova, O. L., and
Williams, A.G. (2011). The dependence of
preferred competitive racing distance on muscle fibre type composition and ACTN3 genotype in speed skaters. Exp Physiol. 96(12): 1302–1310. https://doi.org/10.1113/expphysiol.2011.060293
Baird, M.F., Graham, S.M., Baker, J.S., y Bickerstaff, G.F. (2012).
Creatine-kinase-and exercise-related muscle damage implications for muscle
performance and recovery. J Nutr Metab,
2012;2012:960363. https://doi.org/10.1155/2012/960363
Bar-Or, O. (1987). The Wingate anaerobic test an update on methodology,
reliability and validity. Sports Medicine,
4(6), 381-394. https://doi.org/10.2165/00007256-198704060-00001
Beggs, A. H., Byers, T.J., Knoll, J.H., Boyce, F.M., Bruns, G.A., y
Kunkel, L.M. (1992). Cloning and Characterization of Two Human Skeletal Muscle
Alpha-Actinin Genes Located on Chromosomes 1 and 11. J Biol Chem, 267(13),
9281-9288.
Belli, T., Crisp, A. H., y Verlengia, R. (2017). Greater muscle damage
in athletes with ACTN3 R577X
(RS1815739) gene polymorphism after an ultra-endurance race: a pilot study. Biol Sport, 34(2), 105-110. https://doi.org/10.5114/biolsport.2017.64583
Bray, M.S., Hagberg, J.M., Pérusse, L., Rankinen, T., Roth, S.M.,
Wolfarth, B., y Bouchard, C. (2009). The human gene map for performance and
health-related fitness phenotypes: the 2006–2007 update. Med Sci Sports Exerc, 41(1),
35–73. https://doi.org/10.1249/MSS.0b013e3181844179
Broos, S., Malisoux, L., Theisen, D., van Thienen, R., Ramaekers, M.,
Jamart, C., …, and Francaux, M. (2016). Evidence for ACTN3 as a speed gene in isolated human muscle fibers. PLoS One. 11(3): 1-11. https://doi.org/10.1371/journal.pone.0150594
Broos, S., Van Leemputte, M., Deldicque, L., y Thomis, M. A. (2015). History-dependent force, angular velocity and muscular endurance in ACTN3 genotypes. Eur J Appl Physiol, 115,
1637–1643. https://doi.org/10.1007/s00421-015-3144-6
Clarkson, P. M., Hoffman, E. P., Zambraski, E., Gordish-Dressman, H.,
Kearns, A., Hubal, M., … y Devaney, J. M. (2005). ACTN3 and MLCK genotype
associations with exertional muscle damage. J
Appl Physiol, (1985), 99(2), 564-569. https://doi.org/10.1152/japplphysiol.00130.2005
Del
Coso, J., Valero, M., Salinero, J.J., Lara, B., Díaz, G., Gallo-Salazar, C., …
y Cacabelos. (2017). ACTN3 genotype
influences exercise-induced muscle damage during a marathon competition. Eur J Appl Physiol, 117(3), 409-416. https://doi.org/10.1007/s00421-017-3542-z
Faul, F., Erdfelder,
E., Lang, A.G., y Buchner, A. (2007). G*Power 3: a flexible statistical power
analysis program for the social, behavioral, and biomedical sciences. Behav Res Methods, 39(2), 175-191. https://doi.org/10.3758/BF03193146
Güereca-Arvizuo,
J., Ramos-Jiménez, A., Flores-Martínez, N., Reyes-Leal, G y Hérnandez-Torres,
R.P. (2017). ACTN3 genotypes and their association with athletes
somatotype: Results of a pilot study. ECORFAN-Ecuador
Journal 2017 4(6), 10-17.
Hammouda, O., Chtourou,
H., Chaouachi, A., Chahed, H., Ferchichi, S., Kallel, C., … y Souissi, N.
(2012). Effect of short-term maximal exercise on biochemical markers of muscle
damage, total antioxidant status, and homocysteine levels in football players. Asian J Sports Med, 3(4), 239-246. https://doi.org/10.5812/asjsm.34544
Heath, B., and Carter,
J.E. (1990). Somatotyping Development and Applications. Cambridge university
press.
Hoffman, M. D., Ingwerson, J. L., Rogers, I. R., Hew-Butler, T., y
Stuempfle, K. (2012). Increasing creatine kinase concentrations at the 161-km
Western States Endurance Run. Wildernees
Environ Med, 23(1), 56-60. https://doi.org/10.1016/j.wem.2011.11.001
Jansson, E., y Sylvén, C. (1985). Creatine kinase MB and citrate
synthase in type I and type II muscle fibres in trained and untrained men. Eur J Appl Physiol Occup Physiol, 54(2),
207-209. https://doi.org/10.1007/BF02335931
Landau, M. E., Kenney, K., Deuster, P., Gonzalez, R. S.,
Contreras-Sesvold, C., Sambuughin, N., O’Connor, F. G., y Cambell, W. (2012).
Investigation of the relationship between serum creatine kinase and genetic
polymorphisms in military recruits. Military
Medicine, 177(11), 1359-1365. https://doi.org/10.7205/MILMED-D-12-00086
Lee, F., Houweling, P., North, K., y Quinlan, K. (2016). How does
alfa-actinin-3 deficiency alter muscle function? Mechanistic insights into ACTN3, the gene for speed. (2016). Biochimica et Biophysica Acta, 1863.
868-893. https://doi.org/10.1016/j.bbamcr.2016.01.013
MacArthur, D. G., y North, K. N. (2004). A gene for speed? The evolution
and function of α-actinin-3. Bioessays, 26(7),
786-795. https://doi.org/10.1002/bies.20061
MacArthur, D. G., Seto, J. T., Chan, S., Quinlan, K. G., Raftery, J. M.,
Turner, N., … y North, K. N. (2008). An Actn3 knockout mouse provides
mechanistic insights into the association between alpha-actinin-3 deficiency and
human athletic performance. Hum Mol Genet, 17(8), 1076-1086. https://doi.org/10.1093/hmg/ddm380
Martínez-Abat, A., Boulaiz, H., Prados, J., Marchal, J., Padial, P.,
Caba, O., Rodriguez-Serrano, F., Aranega, A. (2005). Release of A-Actin into
serum after skeletal muscle damage. Br J
Sports Med, 39(11), 830-834). https://doi.org/10.1136/bjsm.2004.017566
Meltzer,
H.Y. (1971). Factors affecting serum creatine phosphokinase levels in the
general population: the role of race, activity and age. Clin Chim Acta, 33, 165-172. https://doi.org/10.1016/0009-8981(71)90264-6
Mikami, E., Fuku, N., Murakami, H., Tsuchie, H., Takahashi, H., Ohiwa, N.,
… y Tanaka, M. (2014). ACTN3 R577X
Genotype is Associated with Sprinting in Elite Japanese Athletes. Int J Sports Med, 35(2), 172-177. https://doi.org/10.1055/s-0033-1347171
Olds, T., Norton, K., and Clark, J. (2000). LifeSize user manual release
1.0 Educational Software for Body Composition Analysis. Australia: Human Kinetics, Inc.
Orysiak, J., Busko, K., Michalski, R., Mazur-Różycka, J., Gajewski,
J., Malczewska-Lenczowska, J., … y Pokrywka, A. (2014). Relationship between ACTN3 R577X polymorphism and maximal
power output in elite Polish athletes. Medicina, 50(5), 303-308. https://doi.org/10.1016/j.medici.2014.10.002
Pimenta, E. M., Coelho,
D. B., Cruz, I. R., Morandi, R. F., Veneroso, C. E., de Azambuja Pussieldi, G.,
Carvalho, M. R., Silami-Garcia, E., De Paz Fernández, J. A. (2012). The ACTN3 genotype in soccer
players in response to acute eccentric training. Eur J
Appl Physiol, 112(4),
1495-1503. https://doi.org/10.1007/s00421-011-2109-7
Rodas, G., Ventura, J. L., Cadefau,
J. A., Cussó, R., y Parra, J. (2002). Un programa de entrenamiento intenso para
un rápido mejoramiento tanto del metabolismo aeróbico como del anaeróbico. Apunts Medicina de I’Esport, 37(140), 5-12. https://doi.org/10.1016/S1886-6581(02)76031-3
Saunders, C. J., September, A. V., Xenophontos, S. L.,
Cariolou, M. A., Anastassiades, L. C., Noakes, T. D., y Collins, M. (2007). No association of the ACTN3 gene
R577X polymorphism with endurance performance in Ironman Triathlons. Ann Hum Genet, 71(Pt 6), 777-781. https://doi.org/10.1111/j.1469-1809.2006.00385.x
Schumann, G., y Klauke, R. (2003). New IFCC reference procedures for the
determination of catalytic activity concentrations of five enzymes in serum:
preliminary upper reference limits obtained in hospitalized subjects. Clin Chim Acta, 327(1-2), 69-79. https://doi.org/10.1016/S0009-8981(02)00341-8
Seto, J., Lek, M., Quinlan, K., Houweling, J., Zheng, X., Garton, F., …
North, N. (2011). Deficiency of alfa-actinin-3 is associated with increased
susceptibility to contraction-induced damage and skeletal muscle remodeling. Human molecular genetics, 20(15),
2914-2927. https://doi.org/10.1093/hmg/ddr196
Thomas, S., Reading, J., y Shephard, R.J. (1992). Revision of the Physical Activity Readiness Questionnaire (PAR-Q).
Can J Spt Sci, 17(4), 338-345.
Venckunas, T., Skurvydas, A., Brazaitis, M., Kamandulis, S., Snieckus,
A., y Moran, C. N. (2012). Human alpha-actinin-3
genotype association with exercise-induced muscle damage and the repeated-bout
effect. Appl. Physiol.Nutr. Metab, 37, 1-9. https://doi.org/10.1139/h2012-087
Vincent, H.K., Vincent, K.R. (1997). The effect of training status on
the serum creatine kinase response, soreness and muscle function following
resistance exercise. Int J Sports Med
1997, 18(6), 431-437. https://doi.org/10.1055/s-2007-972660
Vincent, B., Windelinckx, A., Nielens, H., Ramaekers, M., Van Leemputte,
M., Hespel, P., y Thomis, M. A. (2010). Protective role of α-actinin-3 in the response to an acute eccentric exercise bout. J Appl Physiol (1985), 109(2), 564–573. https://doi.org/10.1152/japplphysiol.01007.2009
Wu, H. J., Chen, K. T., Shee, B. W., Chang, H. C., Huang, Y. J., y Yang,
R. S. (2004). Effects of 24 h ultra-marathon on biochemical and hematological
parameters. World J Gastroenterol, 10(18), 2711-2714. https://doi.org/10.3748/wjg.v10.i18.2711
Yang, N., MacArthur, D.G., Gulbin, J., Hahn, A., Beggs, A.H., Eastel,
S., y North, K. (2003). ACTN3
Genotype Is Associated with Human Elite Athletic Performance. Am J Hum
Genet, 73(3), 627–631. https://doi.org/10.1086/377590
Zanoteli, E., Lotuffo, R., Oliveira, A., Beggs, A. H.,
Canovas, M., Zatz, M., y Vainzof, M. (2002). Deficiency
of Muscle α-Actinin-3
is compatible with high muscle performance. J Mol Neurosci, 20(1), 39-42. https://doi.org/10.1385/JMN:20:1:39
Número de citas totales / Total references:37 (100%)
Número de citas propias de la revista /Journal’s own references:0 (0%)
Rev.int.med.cienc.act.fís.deporte- vol. X -
número X - ISSN: 1577-0354