 Bermejo,
J.L.; Marco-Ahulló, A.; Ribeiro do Couto, B.; Monfort-Torres, G.; Pardo, A. (2021)
Effect of High Intensity Strength Exercise on Cognitive Performance. Revista Internacional de
Medicina y Ciencias de la Actividad Física y el Deporte vol. 21 (84) pp. 653-665. Http://cdeporte.rediris.es/revista/revista84/artefecto1298.htm
Bermejo,
J.L.; Marco-Ahulló, A.; Ribeiro do Couto, B.; Monfort-Torres, G.; Pardo, A. (2021)
Effect of High Intensity Strength Exercise on Cognitive Performance. Revista Internacional de
Medicina y Ciencias de la Actividad Física y el Deporte vol. 21 (84) pp. 653-665. Http://cdeporte.rediris.es/revista/revista84/artefecto1298.htm
DOI: https://doi.org/10.15366/rimcafd2021.84.002
ORIGINAL
EFECTO DE UN EJERCICIO DE
FUERZA DE ALTA INTENSIDAD SOBRE EL RENDIMIENTO COGNITIVO
EFFECT OF HIGH INTENSITY STRENGTH EXERCISE ON COGNITIVE PERFORMANCE
Bermejo,
J.L.1;
Marco-Ahulló, A.2;
Ribeiro do Couto, B.3;
Monfort-Torres, G.4
y Pardo, A.5
1 Profesor Asociado en la
Facultad de Ciencias de la Actividad Física y el Deporte, University of Valencia, Valencia (España) j.luis.bermejo@uv.es
2 Doctor en Ciencias de
la Actividad Física y el Deporte. Departamento de Neuropsicología, metodología,
psicología social y básica. Facultad de Psicología. Universidad Católica de
Valencia, Valencia (España) adria.marco@ucv.es
3 Doctor en Psicobiología.
Department of
Human Anatomy and Psychobiology Faculty of Psychology, University of
Murcia (España) bruno.ribeiro@um.es
4
Profesor
universitario en la Unidad de Educación
de Florida Universitaria, Catarroja, Valencia (España) gonzalomonfort@gmail.com
5 Profesor Ayudante
Doctor en la Facultad de Ciencias de la Actividad Física y el Deporte,
University of Valencia, Valencia (España) alberto.pardo@uv.es
Código UNESCO / UNESCO code: 241106 Fisiología del Ejercicio / 241106 Exercise Physiology
Clasificación Consejo de Europa /
Council of Europe classification: 6. Fisiología del ejercicio / Exercise Physiology.
Recibido 30 de septiembre de
2019 Received September 30, 2019
Aceptado 26 de enero de
2020 Accepted January 26, 2020
RESUMEN
OBJETIVO. El objetivo principal de este
estudio fue dilucidar los efectos de un ejercicio de fuerza de alta intensidad
hasta el fallo en las respuestas conductuales y fisiológicas. El segundo
objetivo fue evaluar el efecto del desempeño de las tareas cognitivas sobre los
niveles de cortisol. MÉTODOSː Catorce sujetos activos completaron un
ejercicio de estrés físico compuesto de 6 series de sentadillas hasta el fallo.
El cortisol salival y las funciones cognitivas se evaluaron de forma
contrabalanceada antes y después del ejercicio. RESULTADOS: Se mostraron
niveles de cortisol más bajos antes del ejercicio y más altos antes de la tarea
cognitiva (p<0.05). CONCLUSIONES: El estrés inducido por el ejercicio tuvo
un efecto perjudicial en la atención. Además, los efectos del estrés en el
rendimiento cognitivo parecen depender del tiempo transcurrido entre el cese
del ejercicio y la evaluación de estos, pero no del tipo de ejercicio de alta
intensidad realizado.
PALABRAS
CLAVE:
Fuerza, estrés, cortisol, rendimiento cognitivo, sentadilla
ABSTRACT
OBJECTIVES. The first aim of this study was to
elucidate the effects of a single high intensity strength exercise until
failure on behavioral (i.e., attention) and physiological
(i.e., salivary cortisol) responses. The second goal was to evaluate the effect
of the performance of the cognitive tasks on cortisol levels. METHODS. Fourteen physically active subjects
completed a physical stress exercise consisting of 6 sets of squat
repetitions to failure. Salivary
cortisol and cognitive functions were evaluated in counterbalanced order prior
to and following exercise-induced stress. RESULTS. The results showed lower
cortisol levels before the exercise and higher cortisol values before the
cognitive task (p<0.05). CONCLUSIONS. Exercise-induced stress had a
detrimental effect on attention. Furthermore, the effects of stress on
cognitive performance seem to depend on the time elapsed between the cessation
of the exercise and the evaluation of these but not the type of high intensity
exercise performed.
KEYWORDS: Strength, stress, cortisol, cognitive performance, squat.
1. INTRODUCCIÓN
Los efectos producidos
por el ejercicio físico sobre diferentes variables psicológicas y/o
fisiológicas pueden analizarse de forma puntual (estudiando el rendimiento
inmediatamente después de realizar una actividad física), o analizando los
cambios producidos por la intervención a lo largo del tiempo (efectos crónicos)
(1,2). En el caso del ejercicio físico de alta intensidad,
debemos tener en cuenta que las catecolaminas, la hormona del crecimiento, la
hormona adrenocorticotrópica, la prolactina y el
cortisol aumentan, y que las gonadotropinas hipofisarias descienden, actuando
como un estresor (3).
Algunas hormonas han
sido muy estudiadas en relación con el ejercicio físico de alta intensidad.
Específicamente, los cambios en la testosterona, el cortisol y su relación
(T/C) se han considerado indicadores de adaptación al esfuerzo físico puntual y
crónico (4). En general, la intensidad de las cargas de ejercicio
afecta la producción de cortisol, observando que en el caso de valores cercanos
al umbral anaeróbico (aproximadamente el 80% del VO2máx) o intensidades que
causan agotamiento, hay un aumento de las hormonas del estrés (adrenalina y
cortisol) que rápidamente conduce a un estado de sobrecarga psicofísica (5). Este estrés produce aumentos de las concentraciones de
cortisol en la sangre y la saliva (6,7) y ambos parámetros están estrechamente relacionados (8). Por lo tanto, los procesos catabólicos se ven favorecidos
sobre los anabólicos, lo que beneficia el ajuste del organismo a corto pero no
a largo plazo (9).
En consecuencia, en lo
que respecta a los vínculos entre el cortisol y el ejercicio, el cortisol puede
estar relacionado con los efectos del ejercicio sobre la cognición (10). De hecho, Heaney et al. (11) descubrieron en un estudio previo que los efectos
beneficiosos de un solo episodio de ejercicio de alta intensidad en el
rendimiento cognitivo podrían atribuirse a disminuciones agudas en los niveles
de cortisol. Sin embargo, aunque trabajos anteriores han demostrado que el
cortisol puede modular el rendimiento cognitivo (es decir, atención y memoria),
algunos de ellos presentan hallazgos contradictorios entre sí, dejando esta problematica aún sin resolver (10,12,13). De hecho, el patrón de efectos del cortisol en la cognición
parece seguir una curva en forma de U invertida (14), es decir, mientras que los niveles moderados se asocian
con una mejora en el rendimiento cognitivo (15,16), los niveles más altos de cortisol interfieren con las
funciones cognitivas, que dependen en gran medida de las redes prefrontales (es
decir, control inhibitorio, regulación de la atención y recuperación de la
memoria) (15,17,18).
La mayoría de las
investigaciones sobre el ejercicio físico de alta intensidad que se han
centrado en el estudio de estos efectos se han realizado con protocolos basados
en ejercicios aeróbicos cortos y/o largos (19,20). No obstante, la literatura científica que examina los
efectos agudos del ejercicio de fuerza sobre el rendimiento cognitivo es más
limitada (21), y se necesita más investigación para facilitar nuestra
comprensión de si el ejercicio de fuerza beneficia el rendimiento cognitivo.
Teniendo todo esto en
cuenta, parece que el estudio del efecto concurrente de un ejercicio de alta
intensidad sobre el rendimiento cognitivo y el sistema endocrinológico ha
arrojado resultados inconsistentes. Por ello, los autores plantean la hipótesis de que el rendimiento cognitivo disminuye después
del estrés inducido por el ejercicio de fuerza cuando coincide con el pico
máximo de cortisol. Con el fin de confirmar o desmentir dicha hipótesis, los objetivos de este estudio fueron dilucidar
los efectos de un ejercicio físico de fuerza de alta intensidad hasta el fallo
en las respuestas conductuales (atención) y fisiológicas (cortisol salival), y
evaluar el efecto del desempeño de las tareas cognitivas sobre los niveles de
cortisol.
2.
MATERIAL Y MÉTODOS
2.1 Muestra
Para determinar el
tamaño de muestra apropiado para este estudio, se realizó un análisis previo de
la potencia estadística utilizando el software de libre disponibilidad G*Power 3.1.9 (Universidad de Düsseldorf, Düsseldorf,
Alemania). El cálculo del tamaño del efecto se basó en revisiones recientes
sobre los estresores agudos y las respuestas de cortisol (12) y el efecto del ejercicio de alta intensidad sobre el
rendimiento cognitivo (22). El tamaño óptimo de la muestra es de 14 participantes, y
se calculó fijando la probabilidad de un error tipo 1 en un alfa de 0.05 , y
una potencia estadística de 0,80 para lograr un tamaño de efecto de 0,28. 14
hombres sanos [media (Desviación Estándar (DE)); edad: 32,5 (0,96) años; peso:
78.02 (1,63) Kg; altura: 175,35 (2,5)] fueron reclutados para participar en
este estudio. Todos los sujetos estaban familiarizados con el entrenamiento de
fuerza (al menos 1h al día 5 días/semana de práctica de actividad física) y una
capacidad para levantar su peso corporal al menos 1,5 veces durante el
ejercicio de media sentadilla. Además, estaban exentos de antecedentes de
enfermedades neurológicas o psiquiátricas y declararon que no eran consumidores
de drogas o de medicamentos que podrían influir en los resultados.
Los sujetos dieron su
consentimiento informado para participar en el estudio. Los protocolos
utilizados en este trabajo de investigación recibieron la aprobación del Comité
de Ética de la Universidad de Valencia. Estos protocolos también cumplieron los
requisitos establecidos en la Declaración de Helsinki de 1975, que fue revisada
posteriormente en 2008.
2.2 Procedimiento
Se llevó a cabo un
diseño intrasujeto en dos sesiones experimentales,
con un intervalo de 48 horas entre ellas: día 1, aprendizaje y protocolo de
carga incremental para alcanzar la curva de 1RM (1 repetición máxima) y
fuerza-velocidad en posición de media sentadilla (1RMMS); día 2,
sesión de sentadillas inducida por estrés y tarea cognitiva. Para excluir los
efectos de confusión debido a las variaciones circadianas del cortisol, todas
las pruebas se realizaron por la tarde entre las 13:30 y las 18:00 h (23).
Previamente a la
adquisición de datos, los investigadores informaron a los participantes sobre
el protocolo a realizar. Los sujetos dieron su consentimiento para participar
en el estudio. En esta sesión, los investigadores indicaron a los sujetos que
no debían tomar estimulantes 24 horas antes del estudio (ej. café, bebidas
energéticas…).
Día 1, prueba
preliminar
Después de llegar al laboratorio,
los participantes fueron equipados con un monitor Polar RS800CX HR (Polar
Electro Ltd., Kempele, Finlandia). Posteriormente,
los participantes pasaron una fase de relajación en una camilla y se controló
su respiración mediante el tempo de un metrónomo que marcaba un ritmo de 40
golpeos por minuto durante 10 min. A continuación, los participantes
completaron la tarea cognitiva: Tarea de Vigilancia Psicomotora (TVP), para
familiarizarse con la tarea. Por último, se utilizó un protocolo de carga incremental
para calcular 1RMMS de acuerdo con la ecuación de Brzycki (24), empleando un máximo de 7 repeticiones. Los parámetros
cinemáticos para cada repetición se calcularon utilizando un sistema de
medición dinámico (T-Force System;
Ergotech, Murcia, España). Se determinó la carga
óptima (OL), lo que nos permitió seleccionar qué tres cargas usar para cada
sujeto durante la sesión 2. El comportamiento de la potencia muscular durante
los entrenamientos se midió usando tres combinaciones de carga/velocidad (baja,
óptima y pesada) (25).
Día 2, prueba de
protocolo
En la sesión 2 (48 h
después de la primera), todos los participantes fueron equipados con un Polar
RS800CX HR y repitieron la fase de relajación. Antes de esto, cada participante
realizó dos series de media sentadilla para cada una de las tres condiciones de
carga: óptima u OL, baja (15% por debajo de OL) y pesada (15% por encima de
OL); sumando un total de seis series. Cada serie se realizó hasta el fallo o
llegando a un máximo de 20 repeticiones. Todos los participantes realizaron la
media sentadilla utilizando estas cargas en orden creciente y todas las
repeticiones se llevaron a cabo lo más rápido posible. El tiempo de
recuperación entre series de la misma carga fue de 1 minuto, y de 3 minutos
entre series de diferentes cargas (26).
Durante esta sesión, el
desempeño cognitivo de los participantes fue evaluado a través de la Tarea de
Vigilancia Psicomotora (TVP) para medir la vigilancia. Las funciones cognitivas
se evaluaron antes y 15 minutos después del estrés físico, coincidiendo con las
concentraciones más altas esperadas de cortisol (23). Después de completar ambas tareas cognitivas, se tomaron
de nuevo medidas del cortisol. La configuración experimental se representa en
la Figura 1.
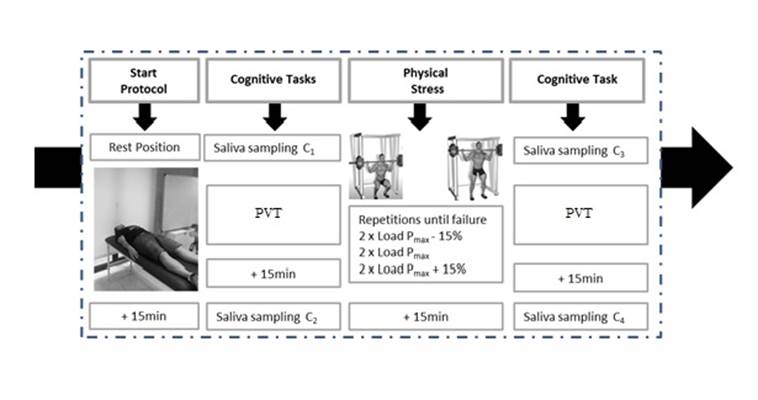
Figura1.
Protocolo del estudio.
2.3 Medidas y
materiales
2.3.1 Muestreo de
saliva y análisis de cortisol.
Se recogieron muestras salivales
cuatro veces durante la sesión y de acuerdo con los criterios establecidos por (27): C1 (después de que los participantes terminaron la fase
de relajación), C2 (15 minutos después de las tareas cognitivas y antes del
comienzo del ejercicio de estrés físico), C3 (15 minutos después del estrés
muscular ejercicio terminado) y C4 (15 minutos después de finalizar las tareas
cognitivas).
Las muestras de saliva
se recolectaron con una "salivette"
(SARSTEDT S.A., España). Todos los participantes recibieron instrucciones para
recolectar adecuadamente la muestra de saliva. Se tuvo cuidado de que los
participantes no se hubieran cepillado los dientes, comido o bebido nada 30
minutos antes de tomar la muestra de saliva.
Los procedimientos de
investigación y la recolección de muestras de saliva se establecieron teniendo
en cuenta el intervalo de tiempo entre estos procedimientos y el despertar. Las
muestras se almacenaron en un congelador a –20 ° C, y luego se analizaron
utilizando kits comerciales ELISA de cortisol salival (DRG Instruments GmbH, Alemania). Todas las muestras fueron analizadas
simultáneamente y por duplicado.
2.3.2 Tarea de
vigilancia psicomotora (TVP)
La tarea TVP se basa en
la establecida originalmente por Wilkinson y Houghton (1982). Esta fue diseñada
para medir la atención sostenida al registrar el tiempo de reacción de los
participantes a los estímulos visuales en intervalos aleatorios. Usando el
software E-Prime ® (Schneider, Eschman y Zuccolotto, 2002) y ordenadores portátiles, se generaron
estímulos computarizados de 15'' para medir esta función. Además, la
adquisición y el análisis de datos se realizaron con este software. En cada
prueba, se mostraban barras horizontales negras en una pantalla sobre un fondo
gris. Las barras luego cambiaron a una posición vertical a intervalos de tiempo
aleatorios [de 2000 a 10000 milisegundos (ms)]. Los participantes recibieron
instrucciones de responder lo más rápido posible para detectar el cambio.
Debían responder con su mano dominante presionando la barra espaciadora de la
computadora portátil. El tiempo medio de reacción (TR) se calculó como la media
del tiempo transcurrido entre la presentación del estímulo y la respuesta. Las
respuestas de anticipación se consideraron como TR <150 ms y los lapsos
TR> 500 ms. La duración de la tarea fue de 9 minutos divididos en tres
bloques de tres minutos cada uno.
Análisis estadístico
El análisis estadístico
se realizó mediante el uso del paquete estadístico SPSS 21 para Windows (IBM Corporation, Armonk, NY). En
primer lugar se analizaron los estadísticos descriptivos de la media y la
mediana como medidas de tendencia central, y la desviación estándar y rango
intercuartílico como medidas de dispersión. El supuesto de normalidad se
verificó mediante la prueba Kolmogorov-Smirnov. En el
caso del cortisol, se aplicó un análisis paramétrico porque esta variable pasó
la prueba de normalidad una vez que se logró la transformación logarítmica. A
continuación se realizó un ANOVA de medidas repetidas con dos factores [estado
de estrés (pre y post estrés) y tiempo de prueba (tarea cognitiva pre y post)].
Posteriormente, se realizó la comparación por pares con la corrección de
Bonferroni.
Con respecto a los
datos adquiridos sobre variables cognitivas durante la tarea, se calculó el TR,
lapsos (LP) y las anticipaciones (AT) para cada participante. El RT se calculó
como la media del tiempo transcurrido entre la presentación del estímulo y la
respuesta. Los ensayos con un tiempo de reacción inferior a 100 ms se
calcularon como AT, y aquellos con un tiempo de reacción superior a 500 ms como
LP. Además, la tarea se dividió en 3 bloques de 3 minutos y se calcularon
variables para cada bloque.
Los principales efectos
de interacción del estado de estrés y el bloque en TR se probaron utilizando un
ANOVA de medidas repetidas de dos factores [estado de estrés (pre y post
estrés) y bloque (bloque 1, 2 y 3)]. Cuando se encontraron efectos
significativos, se solicitaron comparaciones por pares con la corrección de
Bonferroni. Finalmente, AT y LP se analizaron usando una prueba no paramétrica
(es decir, estas variables no pasaron el supuesto de normalidad).
Concretamente, se aplicó la prueba de rangos de Wilcoxon para verificar las diferencias
entre el estrés físico previo y posterior. Además, se aplicó un ANOVA de
Friedman para determinar los efectos de bloque en estas variables, ya que cada
persona tiene valores para los tres bloques en los dos puntos de tiempo (estrés
pre y post físico). Seguidamente se aplicó la prueba de rangos de Wilcoxon.
Finalmente, se
realizaron correlaciones de Spearman para establecer relaciones lineales entre
el cortisol y variables cognitivas en el estrés pre y post físico. También
realizamos correlaciones con los valores delta (pre - post). El nivel de
significación se estableció en p = .05 para todo el análisis.
3.
RESULTADOS
3.1 Medidas de cortisol
Nuestros resultados
mostraron un efecto principal significativo del estrés físico del ejercicio de
fuerza [F (1, 13) = 5.89, p = .03, parcial η2 = .31] mostrando que el
cortisol aumentó tras el estrés post-físico con
respecto al estrés pre-físico (Figura 2). Además, se
observó un efecto significativo de la tarea cognitiva, [F (1, 13) = 17.28, p =
0,001, parcial η2 = 0,57], observando valores más bajos de cortisol en la
tarea postcognitiva en comparación con los valores de
la tarea precognitiva. No hubo interacción
significativa entre el estrés inducido por el ejercicio de fuerza × estrés
inducido por la tarea cognitiva, p = 0,347.
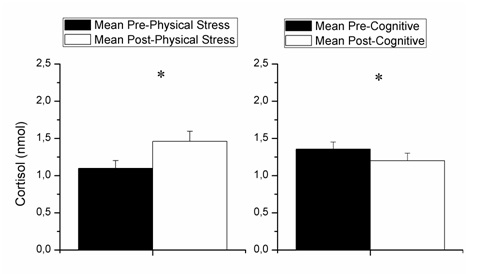
Figura
2. Diferencias entre las muestras de
cortisol analizadas.
3.2 Tarea de vigilancia psicomotora (TVP)
Los
datos de TR mostraron un efecto principal significativo del estrés físico, [F
(1, 13) = 5,66, p = 0,03, parcial η2 = 0,30], observando que en la
condición de estrés pre-físico los participantes
respondieron más rápido (media = 275,43, (DE) = 5,25) que en la condición de
estrés post-físico (media = 291,86, DE = 8,07). Sin
embargo, se encontró un efecto no significativo de bloque, [F (2, 26) = 3.29, p
= 0,053, parcial η2 = 0,20], y de interacción de estrés físico × bloque
significativo, [F (2, 26) = 1,56, p = 0,23, parcial η2 = 0,11].
Además, en los LP, hubo un efecto del estrés
físico (z = -2,07; p = 0,044; r = -0,55). En particular, el número de lapsos
totales en el estrés pre-físico fue menor (media =
1,21, DE = 0,24) que en la condición de estrés post-físico
(media = 2.29, DE = .51). No se encontraron efectos significativos del estrés
físico en las AT de la TVP. Además, no hubo efecto de bloque en los LP y las AT
de la TVP. La Tabla 1 muestra el análisis estadístico descriptivo en los
bloques en lapsos y anticipaciones.
Tabla 1. TR, lapsos y anticipaciones
por bloques
|
|
PVT
Pre fatiga |
PVT
Post fatiga |
||||
|
|
Bloque 1 |
Bloque 2 |
Bloque 3 |
Bloque 1 |
Bloque 2 |
Bloque 3 |
|
TR (Ms) |
267 (5.71) |
273 (6.38) |
284 (6.93) |
282 (8.58) |
300 (10.80) |
292 (9.46) |
|
LP |
.00 (.00) |
.00 (1.0) |
0.50 (1.0) |
.00 (1.0) |
1.0 (1.0) |
.00 (1.0) |
|
AT |
.00 (1.0) |
1.0 (1.25) |
.00 (1.25) |
.00 (0.25) |
.50 (2.0) |
.00 (1.25) |
*Los datos para TR se expresan como media (desviación estándar). Los
datos para LP y AT se expresan como mediana (rango intercuartil).
3.3 Análisis de correlación
El análisis de
correlaciones de Spearman no encontró relación entre el cortisol y ninguna de
las variables cognitivas.
Además, la correlación entre
los valores delta (estrés físico pre y post) también se mostró negativa.
4.
DISCUSIÓN
El objetivo principal
del presente estudio fue describir el efecto agudo del estrés inducido por un
ejercicio de fuerza (6 series de sentadillas) sobre los niveles de cortisol y
la función cognitiva (vigilancia). Los principales resultados mostraron que el
estrés físico (sentadillas) causó un aumento en los niveles de cortisol y
degradó el desempeño de las tareas de vigilancia (TR más altas y mayor número
de lapsos). Por otro lado, debe tenerse en cuenta que el desempeño de las
tareas cognitivas reduce los niveles de cortisol.
En primer lugar, el
completar un protocolo de ejercicio de alta intensidad (sentadillas) podría
conducir a cambios significativos en relación con las demandas fisiológicas y
atencionales. De hecho, las respuestas fisiológicas a un ejercicio de fuerza
(es decir, el cortisol) aumentaron después del protocolo de sentadilla hasta el
fallo. La respuesta hormonal al entrenamiento de fuerza ha mostrado aumentos,
sin cambios o disminuciones en los niveles circulantes de testosterona total en
suero o testosterona libre, y un aumento en el cortisol (28,29).
El entrenamiento de
resistencia y la fuerza producen dos tipos divergentes de estímulos
fisiológicos. El primero implica principalmente ejercicio de intensidad submáxima con resistencia baja o moderada durante un
período prolongado. Por el contrario, como en nuestro caso, el entrenamiento de
fuerza implica ejercicio breve, de alta intensidad e intermitente de gran
resistencia (9).
Los cambios en la testosterona,
el cortisol y su relación (T/C) se han considerado indicadores de adaptación al
esfuerzo físico agudo y crónico (4). Confirmando así que tales protocolos de fatiga
intermitente de fuerza perturban en gran medida el eje Hipotalamo-pituitario-adrenal
(HPA) (7,30).
Con respecto al efecto
de la tarea cognitiva, hubo una disminución del cortisol tras la realización de
la tarea cognitiva posterior al ejercicio, observándose además que el cortisol
disminuyó significativamente en ambas condiciones (pre y post fatiga) después
de la tarea cognitiva. Normalmente, el pico máximo de cortisol se encuentra de
0-20 min después del ejercicio y vuelve a los niveles pre-estresores
en 41-60 min después del final del estresor (12). Estos resultados parecen sugerir que la tarea cognitiva
empleada (TVP) no produjo una tensión mental suficiente para mantener o
aumentar los niveles de cortisol (31).
Además, con respecto a
la TVP, el TR fue significativamente mayor en condiciones de post fatiga que en
condiciones previas a la fatiga. Este hecho contradice los resultados de otros
estudios (21,32,33), que sugieren que las respuestas fisiológicas transitorias
al ejercicio (ej., Endorfinas o serotonina) pueden aumentar el rendimiento
cognitivo (22). Sin embargo, el rendimiento cognitivo disminuye después
de este período transitorio debido a un rápido cese de estas respuestas
fisiológicas al ejercicio (22). En nuestro caso, el participante mostró mayor TR (es
decir, menor rendimiento) desde el primer bloque en comparación con el
rendimiento previo al ejercicio. Además, la precisión de la respuesta (lapsos)
difiere significativamente entre las condiciones previas y posteriores a la
fatiga, mostrando una disminución en la precisión en las condiciones
posteriores a la fatiga. En general, el deterioro se caracterizó por tiempos de
reacción significativamente más lentos y menos respuestas correctas que fueron
particularmente pronunciadas en los primeros bloques después del ejercicio de
estrés.
Según las teorías de la
excitación, la relación entre el estrés y el rendimiento sigue una función en
forma de U invertida (34). Por lo tanto, el tiempo transcurrido entre el ejercicio y
la evaluación de las funciones cognitivas es una variable crucial en los efectos
psicofisiológicos del estrés inducido por el ejercicio (35). Es decir, mientras que la evaluación instantánea con
niveles moderados de estrés provoca una reactividad moderada del cortisol y una
activación del sistema adrenérgico, y a menudo conduce a efectos positivos en
el rendimiento cognitivo (es decir, TR más bajo) (21,32,33), la evaluación cognitiva después de un período de tiempo
en el que el estrés agudo produce grandes aumentos en el cortisol (de 15-20
min), provoca una reducción significativa en el rendimiento cognitivo (es
decir, mayor TR y baja precisión) (36–38).
En nuestro estudio,
durante el período de espera de 15 minutos (después del ejercicio) previo a la
recolección de cortisol salival, tuvo lugar una disminución en la activación
del sistema nervioso simpático (predominantemente, en situaciones de estrés y
emergencia) y un aumento en el sistema nervioso parasimpático (predominante en
reposo), lo cual explica el peor desempeño en la tarea de TVP después del
ejercicio de fuerza de alta intensidad.
Teniendo en cuenta que
la función atencional es de vital importancia para el rendimiento deportivo (39,40), los autores creen que los resultados hallados en este
estudio podrían aportar información innovadora y fundamental sobre la necesidad
de controlar y hacer frente al estrés, y el impacto en el rendimiento de esta
función crucial para el proceso de percepción y toma de decisiones. Los
resultados mostrados podrían ser de gran interés para muchas modalidades
deportivas donde la incertidumbre y la adaptabilidad al medio ambiente son
clave.
5.
CONCLUSIONES
En conclusión, realizar
un protocolo de fatiga de fuerza física es un método adecuado para inducir un
estrés suficiente que afecte el eje HPA y que segregue el cortisol. El tiempo
de reacción y el rendimiento de precisión en una tarea cognitiva (es decir,
TVP) disminuye después del estrés inducido por el ejercicio de fuerza cuando
coincide con el pico máximo de cortisol (15 minutos después del ejercicio de
fuerza). Por último y haciendo referencia al segundo objetivo de este estudio,
los efectos del estrés sobre el rendimiento cognitivo parecen depender del
tiempo transcurrido entre el cese del ejercicio y la evaluación de estos, pero
no del tipo de ejercicio de alta intensidad realizado.
Estos resultados
podrían ser de gran interés para los entrenadores y preparadores físicos de
diferentes deportes, y pueden ayudar a organizar mejor la planificación del
entrenamiento para optimizar el rendimiento, aprovechando los diferentes
momentos de excitación adrenérgica para realizar tareas motoras donde el tiempo
de reacción siempre es decisivo para la toma de decisiones (41).
6.
REFERENCIAS BIBLIOGRÁFICAS
1. Lambourne K,
Tomporowski P. The effect of exercise-induced arousal on cognitive task
performance: a meta-regression analysis. Brain Res.
2010;1341:12–24.
2. Bonet J, Parrado E, Capdevila L. Efectos
agudos del ejercicio físico sobre el estado de ánimo y la hrv. Rev Int Med Cienc Act Física Deporte.
2017;17(65):85–100.
3. Tsai C-L, Wang C-H, Pan C-Y,
Chen F-C, Huang T-H, Chou F-Y. Executive function and endocrinological
responses to acute resistance exercise. Front Behav Neurosci. 2014;8:262.
4. Pedersen BK, Hoffman-Goetz
L. Exercise and the immune system: regulation, integration, and adaptation.
Physiol Rev. 2000;80(3):1055–81.
5. Lehmann M, Keul J.
Age-associated changes of exercise-induced plasma catecholamine responses. Eur
J Appl Physiol. 1986;55(3):302–6.
6. Duclos M, Corcuff JB, Arsac
L, Moreau-Gaudry F, Rashedi M, Roger P, et al. Corticotroph axis sensitivity
after exercise in endurance-trained athletes. Clin Endocrinol (Oxf).
1998;48(4):493–501.
7. Labsy Z, Prieur F, Le Panse B,
Do MC, Gagey O, Lasne F, et al. The diurnal patterns of cortisol and dehydroepiandrosterone in relation
to intense aerobic exercise in recreationally trained soccer players. Stress
Amst Neth. 2013;16(2):261–5.
8. Vining RF, McGinley RA. The
measurement of hormones in saliva: possibilities and pitfalls. J Steroid
Biochem. 1987;27(1–3):81–94.
9. Bell G, Syrotuik D, Socha T,
Maclean I, Quinney HA. Effect of Strength Training and Concurrent Strength and
Endurance Training on Strength, Testosterone, and Cortisol. J Strength Cond
Res. 1997;11(1):57.
10. Henckens MJAG, van Wingen GA,
Joëls M, Fernández G. Time-dependent effects of cortisol on selective attention
and emotional interference: a functional MRI study. Front Integr Neurosci.
2012;6:66.
11. Heaney JLJ, Carroll D, Phillips
AC. DHEA, DHEA-S and cortisol responses to acute exercise in older adults in
relation to exercise training status and sex. Age. 2013 Apr;35(2):395–405.
12. Dickerson SS, Kemeny ME.
Acute stressors and cortisol responses: a theoretical integration and synthesis
of laboratory research. Psychol Bull. 2004;130(3):355–91.
13. van Ast VA, Cornelisse S,
Marin M-F, Ackermann S, Garfinkel SN, Abercrombie HC. Modulatory mechanisms of
cortisol effects on emotional learning and memory: novel perspectives. Psychoneuroendocrinology. 2013;38(9):1874–82.
14. Lupien SJ, Maheu F, Tu M, Fiocco
A, Schramek TE. The effects of
stress and stress hormones on human cognition: Implications for the field of
brain and cognition. Brain Cogn. 2007;65(3):209–37.
15. Butler K, Klaus K, Edwards L,
Pennington K. Elevated cortisol awakening response associated with early life
stress and impaired executive function in healthy adult males. Horm Behav.
2017;95:13–21.
16. Guenzel FM, Wolf OT, Schwabe
L. Glucocorticoids boost stimulus-response memory formation in humans.
Psychoneuroendocrinology. 2014;45:21–30.
17. de Veld DMJ, Riksen-Walraven
JM, de Weerth C. Acute psychosocial stress and children’s memory. Stress Amst
Neth. 2014;17(4):305–13.
18. Quesada AA, Wiemers US,
Schoofs D, Wolf OT. Psychosocial stress exposure impairs memory retrieval in
children. Psychoneuroendocrinology. 2012;37(1):125–36.
19. Chang Y-K, Etnier JL.
Exploring the dose-response relationship between resistance exercise intensity
and cognitive function. J Sport Exerc Psychol. 2009;31(5):640–56.
20. Pontifex MB, Hillman CH,
Fernhall B, Thompson KM, Valentini TA. The effect of acute aerobic and
resistance exercise on working memory. Med Sci Sports Exerc. 2009;41(4):927–34.
21. Chang Y-K, Tsai C-L, Huang
C-C, Wang C-C, Chu I-H. Effects of acute resistance exercise on cognition in
late middle-aged adults: general or specific cognitive improvement? J Sci Med
Sport. 2014;17(1):51–5.
22. Chang YK, Labban JD, Gapin
JI, Etnier JL. The effects of acute exercise on cognitive performance: a
meta-analysis. Brain Res. 2012;1453:87–101.
23. Nicolson N. Mesurement of
Cortisol. 2008. 37 p.
24. Brzycki M. Strength
Testing—Predicting a One-Rep Max from Reps-to-Fatigue. J Phys Educ Recreat
Dance. 1993;64(1):88–90.
25. Haff GG, Nimphius S. Training
Principles for Power. Strength Cond J. 2012;34(6):2.
26. Mayhew DL, Thyfault JP, Koch
AJ. Rest-interval length affects leukocyte levels during heavy resistance
exercise. J Strength Cond Res. 2005;19(1):16–22.
27. Chatterton RT, Vogelsong KM,
Lu YC, Hudgens GA. Hormonal responses to psychological stress in men preparing
for skydiving. J Clin Endocrinol Metab. 1997;82(8):2503–9.
28. Ahtiainen JP, Pakarinen A,
Alen M, Kraemer WJ, Häkkinen K. Muscle hypertrophy, hormonal adaptations and
strength development during strength training in strength-trained and untrained
men. Eur J Appl Physiol. 2003;89(6):555–63.
29. Busso T, Häkkinen K,
Pakarinen A, Carasso C, Lacour JR, Komi PV, et al. A systems model of training
responses and its relationship to hormonal responses in elite weight-lifters.
Eur J Appl Physiol. 1990;61(1–2):48–54.
30. Heijnen S, Hommel B, Kibele
A, Colzato LS. Neuromodulation of Aerobic Exercise—A Review. Front Psychol
[Internet]. 2016;6.
31. McEwen BS, Sapolsky RM.
Stress and cognitive function. Curr Opin Neurobiol. 1995;5(2):205–16.
32. Bermejo JL, García-Massó X,
Paillard T, Noé F. Fatigue does not conjointly alter postural and cognitive
performance when standing in a shooting position under dual-task conditions. J
Sports Sci. 2018;36(4):429–35.
33. Hillman CH, Pontifex MB,
Raine LB, Castelli DM, Hall EE, Kramer AF. The effect of acute treadmill
walking on cognitive control and academic achievement in preadolescent
children. Neuroscience. 2009;159(3):1044–54.
34. Joëls M, Pu Z, Wiegert O, Oitzl
MS, Krugers HJ. Learning under
stress: how does it work? Trends Cogn Sci. 2006;10(4):152–8.
35. Crabbe JB, Dishman RK. Brain
electrocortical activity during and after exercise: a quantitative synthesis.
Psychophysiology. 2004;41(4):563–74.
36. Bermejo JL, Couto BR do,
Marco-Ahulló A, Villarrasa-Sapiña I, Garcia-Masso X. Effects of an incremental
maximal endurance exercise stress-induced cortisol on cognitive performance. J
Hum Sport Exerc. 2019;14(3):632–44.
37. Kleider HM, Parrott DJ.
Aggressive shooting behavior: How working memory and threat influence shoot
decisions. J Res Personal. 2009;43(3):494–7.
38. Soga K, Shishido T, Nagatomi
R. Executive function during and after acute moderate aerobic exercise in
adolescents. Psychol Sport Exerc. 2015;16:7–17.
39. Brisswalter J, Collardeau M,
René A. Effects of acute physical exercise characteristics on cognitive
performance. Sports Med Auckl NZ. 2002;32(9):555–66.
40. Furley PA, Memmert D. The role
of working memory in sport. Int Rev Sport Exerc Psychol. 2010;3(2):171–94.
41. Gallego NMS, Maldonado SV, Abellán J,
Contreras OR. El entrenamiento perceptivo de bloqueadoras juveniles de
voleibol. Rev Int Med Cienc Act Física Deporte. 2019;18(69):135–50.
Número
de citas totales / Total references: 41 (100%)
Número
de citas propias de la revista / Journal’s own references: 0 (0%)
Rev.int.med.cienc.act.fís.deporte - vol. 21 - número 84 - ISSN: 1577-0354